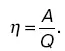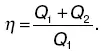Под термодинамикой понимают раздел физики, рассматривающий системы, между которыми возможен обмен энергией без учета микроскопического строения тел, составляющих систему. Различают термодинамику равновесных систем (или систем, переходящих к равновесию) и термодинамику неравновесных систем, которая играет особую роль для рассмотрения биологических систем.
Основные понятия термодинамики. Первое начало термодинамики. Состояние термодинамической системы характеризуется физическими величинами, называемыми параметрами (такими как объем, давление, температура, плотность и т. д.). Если параметры системы при взаимодействии ее с окружающими телами не изменяются с течением времени, то состояние системы называют стационарным. В разных частях системы, находящейся в стационарном состоянии, значения параметров обычно различаются: температура в разных участках тела человека, концентрация диффундирующих молекул в разных частях биологической мембраны и т. п. Стационарное состояние поддерживается за счет потоков энергии и вещества, проходящих через систему. В стационарном состоянии могут находиться такие системы, которые либо обмениваются и энергией, и веществом с окружающими системами (открытые системы), либо обмениваются только энергией (закрытые системы).
Термодинамическая система, которая не обменивается с окружающими телами ни энергией, ни веществом, называется изолированной. Изолированная система со временем приходит в состояние термодинамического равновесия. В этом состоянии, как и в стационарном, 24б параметры системы сохраняются неизменными во времени. Однако существенно, что в равновесном состоянии параметры, не зависящие от массы или числа частиц (давление, температура и др.), одинаковы в разных частях этой системы. Любая термодинамическая система не будет изолированной, так как ее невозможно окружить оболочкой, не проводящей теплоту.
Изолированную систему рассматривают как удобную термодинамическую модель. Закон сохранения энергии для тепловых процессов формулируется как первое начало термодинамики. Количество теплоты, переданное системе, идет на изменение внутренней энергии системы и совершение системой работы. Под внутренней энергией системы понимают сумму кинетической и потенциальной энергий частиц, из которых состоит система.
Внутренняя энергия является функцией состояния системы и для данного состояния имеет вполне определенное значение: DU есть разность двух значений внутренней энергии, соответствующих конечномуи начальному состояниям системы:
DU = U 2– U 1
Количество теплоты, как и работы, является функцией процесса, а не состояния. Первое начало термодинамики можно записать в виде:
dQ = dU + dA.
Значения Q, A, DU и dQ, dA, dU могут быть как положительными (теплота передается системе внешними телами, внутренняя энергия увеличивается), так и отрицательными (теплота отнимается от системы, внутренняя энергия уменьшается).
25. Второе начало термодинамики. Энтропия
Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель второго рода (формулировка Томсона).
Процесс называют обратимым, если можно совершить обратный процесс через все промежуточные состояния так, чтобы после возвращения системы в исходное состояние в окружающих телах не произошло каких-либо изменений.
Коэффициентом полезного действия тепловой машины, или прямого цикла, называют отношение совершенной работы к количеству теплоты, полученному рабочим веществом от нагревателя:
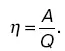
Так как работа тепловой машины совершается за счет количества теплоты, а внутренняя энергия рабочего вещества за цикл не изменяется (DU = 0), то из первого закона термодинамики следует, что работа в круговых процессах равна алгебраической сумме количеств теплоты:
A = Q 1+ Q 2.
Следовательно:
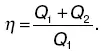
Количество теплоты Q 1, полученное рабочим веществом, положительно, количество теплоты Q 2 , отданное рабочим веществом холодильнику, отрицательно.
Сумму приведенных количеств теплоты для обратимого процесса можно представить как разность двух значений некоторой функции состояния системы, которую называют энтропией:
Читать дальше
Конец ознакомительного отрывка
Купить книгу