В качестве мишений для действия антисмысловых РНК уже испытаны как различные вирусные гены, так и некоторые клеточные гены, «помогающие» вирусу размножаться. В частности, хорошей мишенью оказался ген, кодирующий белок-рецептор CCR5, подавление которого препятствует проникновению вируса в клетку. Анти-ВИЧ-активность присуща и антисмысловой РНК для гена циклофолина А, продукт которого не важен для жизни клетки, но который очень важен для размножения вируса. Возможности использования такого приема для подавления репликации ВИЧ уже показаны на различных простых системах (в частности, в культуре клеток, инфицированных ВИЧ). Не исключено, что по мере совершенствования противо-ВИЧ-антисмысловых конструкций они найдут применения в лечебной практике.
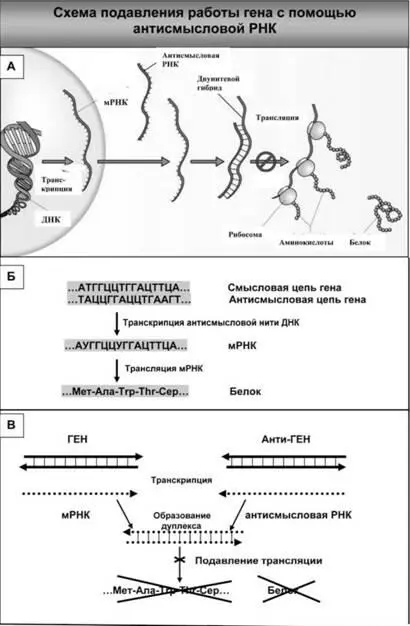
Рис. 31. Применение антисмысловых молекул РНК основано на их способности образовывать двунитевые гибриды (дуплексы) с мРНК и этим препятствовать их трансляции, т. е. образованию белка (А). Ген (участок ДНК, кодирующий белок) состоит из двух комплементарных цепей ДНК (смысловой и антисмысловой) (Б). В ядре клетки транскрибируется антисмысловая цепь, в результате чего образуется комплементарная ей смысловая матричная РНК (мРНК). На ней в результате трансляции синтезируется кодируемый геном белок. Если искусственно сконструировать такой ген (Анти-ГЕН), у которого происходит транскрипция не антисмысловой, а смысловой цепи, то при одновременной работе гена и Анти-ГЕНа образующиеся в клетке мРНК и антисмысловая РНК в силу комплементарности должны формировать двуцепочечные структуры (дуплексы) (В). Находясь в составе дуплекса, мРНК не способна к трансляции, т. е. к синтезу белка, который она кодирует. В результате этого соответствующий белок не образуется в клетке. Если антисмысловая РНК направлена на вирусную мРНК, то синтез этого белка не происходит и ВИЧ не может размножаться
На модельных системах уже опробован и другой вариант подавления ВИЧ-инфекции. Для этой цели используется необычное свойство некоторых молекул РНК — их способность разрушать другие виды РНК. Американцы Т. Чех и С. Альтман за это открытие получили в 1989 г. Нобелевскую премию. И было за что. Ведь до этого считалось, что все биохимические реакции в организме происходят с необходимыми для обеспечения жизни скоростями благодаря высокоэффективным специфическим катализаторам, которыми служат только белки, называемые ферментами. И тут совершенно неожиданно сообщается о существовании в природе некоторых видов РНК, которые подобно белкам обладают высокоспецифической каталитической активностью. После того как стало известно, что определенные РНК обладают ферментативной активностью, их стали называть рибозимами. Рибозимы содержат внутри себя все те же антисмысловые участки, но, кроме того, и участки, осуществляющие ферментативную реакцию. То есть они не просто присоединяются с мРНК, а еще и разрезают ее. Суть приема подавления ВИЧ-инфекции с помощью рибозимов изображена на рис. 32. Присоединяясь к комплементарной РНК-мишени, рибозим расщепляет эту РНК, результатом чего является прекращение синтеза белка, кодируемого РНК-мишенью. Если такой мишенью для рибозима будет вирусная РНК, то рибозим ее «испортит», и соответствующий вирусный белок образовываться не будет. А в результате вирус прекратит свое размножение в клетке. Такой подход в равной мере применим и к некоторым другим патологиям человека, например для лечения рака.
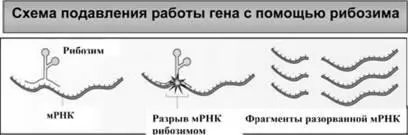
Рис. 32. Подавление вирусной инфекции с помощью рибозимов основано на их способности связываться с определенными участками вирусной мРНК и разрезать ее на куски. B результате исчезновения целостной полноразмерной мРНК синтез соответствующего ей белка происходить не может. Это предотвращает размножение вируса
Серьезные надежды возлагаются в последнее время еще на одно очень интересное направление — избирательное подавление синтеза вирусных белков с помощью механизма РНК-интерференции. B связи с этим сделаем небольшое, но важное отступление.
Давно было известно, что в клетках существует специальный механизм, который мешает распространению вирусной инфекции. Он даже получил свой термин — интерференция. Белки, которые участвуют в этом процессе, были названы интерферонами. B ответ на введение в клетки фрагментов нуклеиновой кислоты длиной более тридцати нуклеотидов (геном всех вирусов имеет больший размер) в их цитоплазме запускается мощный интерфероновый ответ, блокирующий весь белковый синтез (т. е. в данном случае происходит защитный ответ клетки на вирусную инфекцию, который является не специфическим на определенный агент, а общим). И вот недавно открыт совершенно новый способ регуляции работы генов в клетках — механизма РНК-интерференции. Выяснилось, что в клетке существует специальный механизм, способный деградировать строго определенные РНК (без участия рибозимов) и таким образом полностью инактивировать ее. Этот механизм деградации может быть направлен на любую конкретную РНК — клеточную, бактериальную или вирусную. Суть механизма РНК-интерференции заключается в том, что при введении в клетки короткой двуните-вой РНК (днРНК) она способна вызывать специфическое разрушение той мРНК, с которой имеет гомологию. Как теперь выяснено, сначала днРНК разрезается специальным ферментом на короткие фрагменты размером от 19 до 21 пар нуклеотидов. После небольших химических модификаций эти короткие днРНК образуют специфический комплекс с определенными клеточными белками. B этом комплексе днРНК расплетается и становится однонитевой. Затем короткая однонитевая РНК в силу своей комплементарности взаимодействует со строго определенной мРНК (копией гена-мишени), что является сигналом для «разрезания» последней ферментами комплекса. Образующиеся в результате этого короткие фрагменты мРНК уже неспособны обеспечивать синтез полноценного белка. Таким образом, конструируя различные днРНК, можно подавлять синтез строго определенных белков в клетке, не изменяя при этом структуру кодирующих их генов.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













