1 ...5 6 7 9 10 11 ...356 - 21 -
В результате установления закона сохранения массы с конца XVIII века в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава :
Соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения.
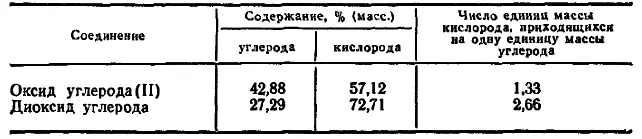
Многие элементы, соединяясь друг с другом, могут образовать разные вещества, каждое из которых характеризуется определенным соотношением между массами этих элементов. Так, углерод образует с кислородом два соединения. Одно из них — оксид углерода (II), или окись углерода — содержит 42,88% (масс.) углерода* и 57,12% (масс.) кислорода. Второе соединение — диоксид, или двуокись углерода — содержит 27,29% (масс.) углерода и 72,71% (масс.) кислорода. Изучая подобные соединения, Дальтон** в 1803 г. установил закон кратных отношений :
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Дальтон придерживался атомной теории строения вещества. Открытие закона кратных отношений явилось подтверждением этой теории. Закон непосредственно свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями. Подсчитаем, например, массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании оксида углерода (II) и диоксида углерода. Для этого разделим друг на друга величины, выражающие содержание кислорода и углерода в том и в другом оксидах. Мы получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II).
* Здесь и ниже процентное соотношение масс будет обозначаться % (масс.), процентное соотношение объемов - % (об.).
** Джон Дальтон (1766-1844), английский ученый, работавший в области физики, химии, метеорологии. Изучая свойства газов, открыл закон парциальных давлений газов. Особенно велики заслуги Дальтона в развитии атомной теории.
- 22 -
Способность элементов вступать в соединения лишь определенными порциями свидетельствовала о прерывном строении вещества. Развивая атомную теорию, Дальтон ввел близкое к современному представление об атомах и об относительных атомных массах элементов; за единицу атомной массы он принял массу атома водорода как самого легкого. Он впервые в истории химии составил таблицу атомных масс, которая включала 14 элементов.
Законы постоянства состава и кратных отношений вытекают из атомно-молекулярного учения. Вещества с молекулярной структурой состоят из одинаковых молекул. Поэтому естественно, что состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, молекула оксида углерода (II) построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атом углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся на одну и ту же массу углерода, во втором из этих соединений в 2 раза больше, чем в первом.
В отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими. В связи с открытием изотопов (§ 35) выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, тяжелая вода (§ 72) содержит около 20% (масс.) водорода, а обычная вода лишь 11%.
В начале XX века Н. С. Курнаков (см. стр. 536), изучая сплавы металлов, открыл соединения переменного состава. В этих соединениях на единицу массы данного элемента может приходиться различная масса другого элемента. Так, в соединении, которое висмут образует с таллием, на единицу массы таллия может приходиться от 1,24 до 1,82 единиц массы висмута.
В тридцатых годах XX века выяснилось, что соединения переменного состава встречаются не только среди соединений металлов друг с другом, но и среди других твердых тел, например, оксидов, соединений металлов с серой, азотом, углеродом, водородом.
Читать дальше
Конец ознакомительного отрывка
Купить книгу












