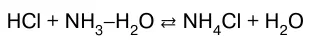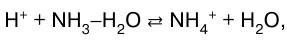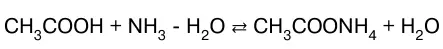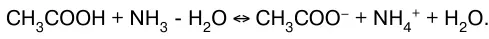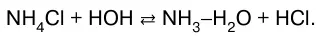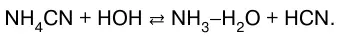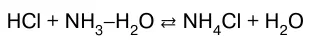
или в молекулярно-ионном виде:
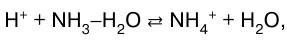
а также – слабого основания слабой кисло–той:
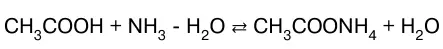
или в молекулярно-ионном виде:
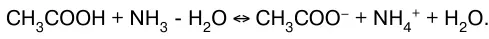
В данных системах равновесие сильно смещено вправо, так как вода значительно более слабый элек–тролит, чем синильная кислота, аммиак и уксусная ки–слота.
Реакции нейтрализации лежат в основе метода нейтра–лизации. Этот метод используют в клинических лабора–ториях для определения кислотности желудочного сока, буферной емкости плазмы крови. В фармакологии его применяют для количественного анализа неорганиче–ских кислот (соляной, серной, борной) и органических кислот (уксусной, бензойной, винной, лимонной, сали–циловой). В биофармацевтических исследованиях методом нейтрализации определяют рК а кислот и рК ь оснований, так как по значению этих величин можно прогнозировать способность лекарственных препара–тов проходить через биологические мембраны.
Применяют кислотно-основное титрование для опре–деления рК ааминокислот и рК адиссоциирующих групп, входящих в белки. По кривым титрования белков, полу–ченным при двух различных температурах, можно опре–делить число карбоксильных, имидазольных и других групп. Титрование аминокислот и белков дает возмож–ность определить их изоэлектрические точки.
Под гидролизом понимают реакцию разложения ве–щества водой.
Гидролизу могут подвергаться химические соедине–ния различных классов: белки, жиры, углеводы, эфиры, соли и т. д. В неорганической химии чаще всего встре–чаются с гидролизом солей.
Гидролиз соли– это взаимодействие соли с мо–лекулами воды, приводящее к образованию малодис-социироваииых соединений.
Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону (СO 3 2-+ НОН * НСO 3 –+ ОН -) или от данного иона, в том числе от гидратиро-ванного катиона металла, к молекуле воды.
В зависимости от природы соли вода выступает ли–бо как кислота, либо как основание, а соль является соответственно сопряженным основанием или сопря–женной кислотой.
Возможны четыре варианта гидролиза в зависимо–сти от типа соли.
1. Соли, образованные сильной кислотой и слабым основанием:
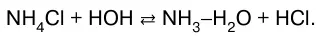
2. Соли, образованные сильным основанием и сла–бой кислотой:
CH 3COONa + НОН → СН 3СOOН + NaOH.
3. Соли, образованные слабой кислотой и слабым основанием.
Цианид аммония гидролизуется по реакции:
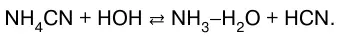
4. Соли, образованные сильной кислотой и сильным основанием.
NaCl, KNO 3 гидролизу не подвергаются. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболоч–кой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одно– основными кислотами. Соли многоосновных кис–лот и многокислотных оснований гидролизуются ступенчато, образуя при этом кислые и основные соли.
Количественно гидролиз как КО-равновесие характе–ризуется степенью гидролиза и константой гидролиза.
Степень гидролиза измеряется отношением коли–чества гидролизованного вещества к общему коли–честву растворенного вещества.
Степень гидролиза зависит от природы соли, ее кон–центрации и температуры. Согласно закону действую–щих масс степень гидролиза возрастает с разбавлением раствора. Так, при концентрации
Na 2CO 30,001 моль/л степень гидролиза составляет 34%.
В общем случае справедливы следующие законо–мерности.
1. Гидролиз соли должен усиливаться с повыше–нием температуры и разбавлением раствора.
2. При обратимом гидролизе в соответствии с прин–ципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кис–лотой и слабым основанием, накапливаются ионы Н) или при подщелачивании (если соль образована сла–бой кислотой и сильным основанием, накапливаются ионы ОН).
Читать дальше
Конец ознакомительного отрывка
Купить книгу