Склад аммиачной воды.Аммиачная вода поступает на заводы в виде 25 %-ного раствора и при такой концентрации хранится в металлических (в черном исполнении) баках различной емкости.
Склад жидком двуокиси серы.Жидкая двуокись серы поступает на склад в железнодорожных цистернах и передавливается в танки сжатым воздухом (давление 8–12 кг/см 2). Обычно устанавливаются три танка: приемный, расходный и резервный. Из танков SO 2сухим сжатым воздухом передавливается в испаритель (змеевиковый подогреватель), где испаряется за счет тепла горячей воды. Подогрев воды до 50° ведется острым паром (с температурой 142,9° и давлением 3 ат), подаваемым в испаритель. Газообразная SO 2после испарителя направляется в производство.
ТЕОРИЯ ПОЛУЧЕНИЯ СУЛЬФИТНОЙ КИСЛОТЫ
Сжигание серусодержащего сырья
Сжигание серы и состав газовой смеси
При горении серы происходит следующая основная реакция
S + O 2= SO 2 + 70 900 кал.
Так как молекулярный вес серы и кислорода одинаков (32), то на 1 кг серы расходуется 1 кг кислорода и образуется 2 кг SO 2.
При сгорании 32 г серы выделяется 70 900 кал, следовательно, при сгорании 1 кг серы выделится тепла
(70 900 1000) / 32 = 2 210 000 кал.
Содержание кислорода в воздухе по объему составляет 21 %, остальные 79 % занимает азот; в случае полного расходования кислорода воздуха на горение максимальное содержание SO 2в газовом смеси составит 21 %. Однако сжигание серы практически происходит с некоторым избытком воздуха, поэтому концентрация SO 2меньше теоретически возможной и составляет 12–15 % (в печах новейшей конструкции до 18 %). Содержание SO 2можно приблизить к теоретически возможному, сжигая серу в чистом кислороде.
Коэффициент избытка воздуха α по по отношению к теоретически необходимому можно вычислить по формуле
α = 21 / %SO 2в газовой смеси.
Для вращающихся печей он составляет 1,25–1,5; для стационарных 1,1–1,2.
Объем воздуха, необходимый для горения 1 т серы, можно подсчитать по формуле
V = 70 °C s/ C SO 2
где: V — объем воздуха при нормальных условиях (при 0 °C и 760 мм рт. ст.), м 3;
C s— содержание выгорающей серы в сырье, %;
C SO 2— содержание SO 2в обжиговом газе, объемных %;
Объем газовой смеси, образующейся при сжигании 1 кг серы, можно подсчитать следующим образом.
Объем 1 кг SO 2при 0° и 760 мм рт. ст. составляет 0,35 м 3, следовательно, при сжигании 1 кг серы образуется около 0,7 м 3SO 2. Если содержание SO 2в газовой смеси C SO 2, %, то объем всей газовой смеси составит
V 0°; 760 мм= (0,70 / C SO 2) 100 = 70 / C SO 2м 3.
При крепости газа 14 % SO 2объем газовой смеси при сгорании 1 кг серы составит
V 0°; 760 мм= 70 / 14 = 5 м 3.
Состав газовой смеси: 14 % SO 2; 79 % N 2; (21–14)=7 % O 2или в объемном выражении:
SO 2= 5 x 0,14 = 0,70 м 3,
N 2= 5 x 0,79 = 3,95 м 3,
O 2= 5 x 0,07 = 0,35 м 3.
В весовом выражении 1 м 3SO 2весит: 2,85 кг; 1 м 3N 2— 1,257 кг; O 2— 1,43 кг. Состав газовой смеси равен:
SO 2= 0,70 x 2,85 = 2 кг, или 26,8 %;
N 2= 3,95 x 1,257 = 4,96 кг, или 66,5 %;
O 2= 0,35 x 1,43 = 0,50 кг, или 6,7 %;
Итого: 7,46 кг, или 100 %.
Для сжигания 1 кг серы при данных условиях потребуется 5 м 3воздуха или 5,0 x 1,293 = 6,46 кг (1 м 3воздуха при 0° и 760 мм рт. ст. весит 1,293 кг), т. е. вес полученной газовой смеси на 1 кг больше затраченного воздуха, так как к весу воздуха присоединяется 1 кг сгоревшей серы.
Объем полученного газа при сжигании 1 т серного сырья определяется по формуле
V H= (100 °C sx 22,4 x 100) / 100 x 32 C SO 2= 70 °C s/ C SO 2 м 3,
V H— объем газа при 0° и 760 мм рт. ст., полученный при сжигании 1 т сырья, м 3;
C s— содержание выгорающей серы в сырье, %;
C SO 2= содержание SO 2в газе, объемных %.
Для определения объема газа при условиях, отличающиеся от нормальных, необходимо его объем пересчитать по формуле
V раб= (V Hx (273 — t)) / 273p м 3,
V раб— объем газа при заданной температуре t и заданном давлении p, мм рт. ст.;
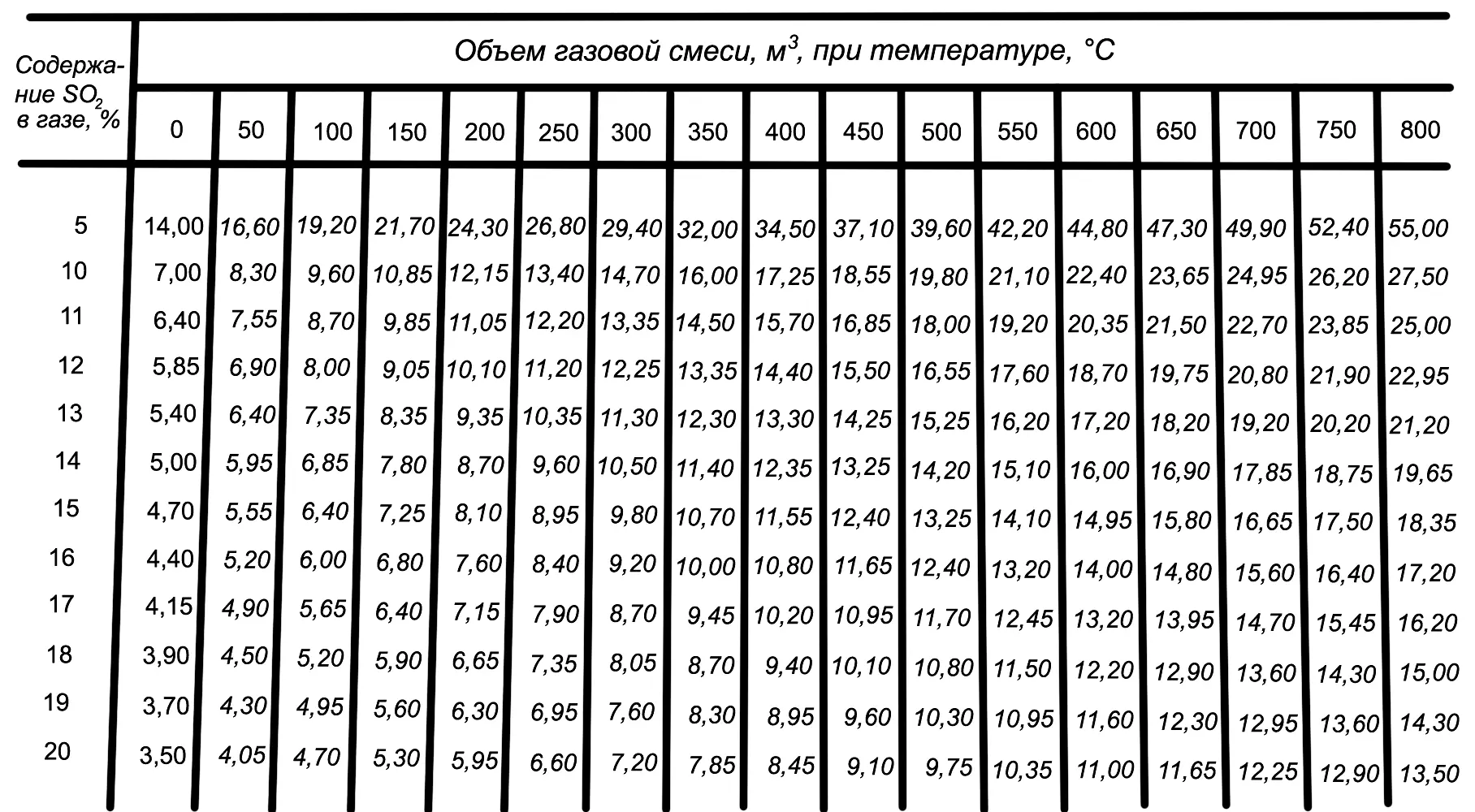
V H — объем газа при нормальных условиях (t=0° и p=760 мм рт. ст.). Количество газа, образующегося при сжигании 1 кг серы, показано в табл. 1.
Таблица 1
Объем газовой смеси, образующейся при сжигании 1 кг серы, в зависимости от концентрации SO 2и температуры
Сжигание колчедана и состав газовой смеси
Основная реакция горения колчедана следующая
4FeS 2 + 11O 2= Fe 2O 3 + 8SO 2 + 815 200
Кроме того, происходит ряд побочных реакций с образованием Fe 3O; и FeO.
Вычисление объема обжигового газа на 1 т колчедана производится по тем же формулам, что и при сжигании серы.
Читать дальше











