Существует и более простой способ проверить концентрацию этанола в водно-спиртовом растворе: достаточно измерить его плотность, которая тем меньше, чем выше доля алкоголя. Измерение осуществляется с помощью ареометра – герметичной стеклянной полой трубки с утяжелителем внизу, которая в зависимости от плотности жидкости погружается в нее в большей или меньшей степени (илл. 6). Принцип работы устройства, вероятно, был известен и при Иване Грозном, но его реализация достаточно сложна, поэтому в те времена он не был широко распространен в России. В конце XIX века император Александр III решил заменить эмпирический критерий Ивана Грозного на точный, научно обоснованный рецепт водки. Император обратился к Дмитрию Менделееву, одному из величайших русских ученых того времени, который рекомендовал содержание спирта в 38 %, округленное впоследствии императором до 40 %. При такой концентрации спирта стакан водки может много часов стоять на открытом воздухе, и алкоголь при этом не улетучится из-за постепенного испарения.
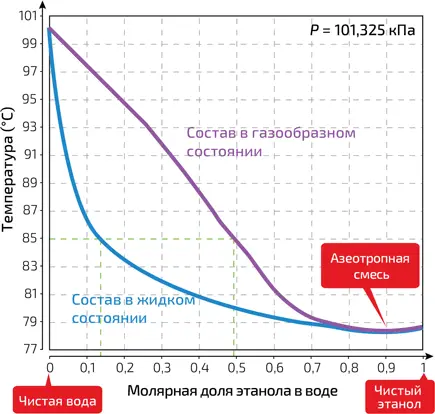
7. Состав жидкой и газообразной фаз водно-спиртового раствора в состоянии равновесия при нормальном атмосферном давлении (101 кПа). Состав каждого состояния указывается на оси абсцисс как молярная доля спирта (которая равна количеству молекул спирта, разделенному на общее количество молекул). Чистая вода закипает при 100 °C, а чистый этанол – при 78,4° C. Между этими двумя температурами сосуществуют две равновесные фазы: например, при 85 °C в жидком состоянии молярная доля спирта около 14 %, в газообразном – около 49 %
Интересно, что существует куда более сильная концентрация, при которой водно-спиртовая смесь испаряется без какого-либо изменения содержания в ней алкоголя вообще (илл. 7). Смесь такой концентрации называется азеотропной : она соответствует спиртовому раствору крепости примерно в 96° (точнее – 93,5 %). Именно по этой причине в аптеке трудно найти более высокую концентрацию спирта, которую невозможно получить путем классической дистилляции (см. врезку «Дистилляция – метод алхимиков»).
Водку пьют охлажденной. Остудить ее в России зимой легко, особенно в Сибири, где средняя температура составляет –10 °C: достаточно ненадолго оставить бутылку на улице. Как известно, если то же самое проделать с бутылкой воды, то бутылка лопнет. При замерзании вода увеличивается в объеме почти на 10 % (см. врезку «Вода – необычная жидкость»). Почему же с бутылкой водки этого не происходит? С одной стороны, как мы видим на илл. 2, водно-спиртовой раствор концентрации в 40°, такой как водка, остается жидким при температурах значительно ниже 0 °C. Если вы для опыта поставите стакан водки в морозильник, то она останется жидкой (конечно, если ваш морозильник не охлаждается до температуры ниже –30 °C). При еще более низких температурах водка все же начинает затвердевать, но происходит это своеобразно: из нее вымораживается вода, то есть образующаяся твердая фаза представляет собой практически чистый лед. Поэтому остающаяся жидкость становится более насыщенным водно-спиртовым раствором и продолжает оставаться жидкой при еще более низких температурах! Таким образом, температура жидкой фазы будет продолжать понижаться до тех пор, пока не сравняется с температурой морозильной камеры. Полностью она перейдет в твердое состояние лишь при температуре порядка –120 °C, которая не наблюдается даже в Антарктиде!
Дистилляция – метод алхимиков
Алхимики были предшественниками современных химиков. Одно из их блестящих изобретений – дистилляция, которая позволяет производить крепкие напитки из вина, или, в более общем плане, разделять жидкую смесь на отдельные компоненты. Рассмотрим илл. 7: при заданной температуре, например 85 °C, вещество в газообразном состоянии, находящееся в равновесии с жидкостью, оказывается намного более насыщенным спиртом. Чтобы увеличить крепость жидкости (например, вина), достаточно просто нагреть его и позволить образовавшемуся пару уйти в холодную емкость, где он сконденсируется. Для практической реализации этого процесса используют так называемый перегонный куб (см. илл.). Например, если постепенно нагревать водно-этаноловую смесь с молярной долей спирта 0,2, то она начинает испаряться при 83,5 °C. Молярная доля спирта в паре уже составит 0,54, и такое же значение будет уже в первых каплях дистиллята. По мере того как испарение продолжается, температура смеси увеличивается и алкоголя становится меньше в обеих фазах, следовательно, уменьшается и концентрация алкоголя в собранной жидкости. Поэтому процесс следует вскоре остановить, пока пар все еще насыщен спиртом.
Читать дальше
Конец ознакомительного отрывка
Купить книгу





![Лина Сайфер - Театр мыльных пузырей [litres]](/books/434478/lina-sajfer-teatr-mylnyh-puzyrej-litres-thumb.webp)






