Давайте попытаемся совместить уравнение Дальтона и результаты исследования Гей-Люссака. Возьмем одинаковое количество атомов в равных объемах газа (при одинаковых температуре и давлении) в соответствии с законом Авогадро.
На рис. 12.1 у нас есть правильные величины объемов каждого газа, вовлеченных в химическую реакцию, как это определил Гей-Люссак, взаимодействующие по правилам уравнения Дальтона. Далее, так как мы используем закон Авогадро, количество атомов в каждом объеме должно быть одинаковым, но какое именно это количество — неважно.
По-видимому, в этой схеме есть неточность, поскольку в результате процесса у нас остаются атомы водорода. Это было бы нормально, если бы мы знали, что так и происходит, но экспериментальные свидетельства показывают, что нет. Давайте исключим из нашего процесса уравнение Дальтона — в конце концов, это были всего лишь его размышления. Вместо этого допустим, что атомы одного и того же элемента в газообразном состоянии могут объединиться, чтобы формировать молекулы, как считал Авогадро, а не существуют в виде отдельных атомов, как того требовал Дальтон.
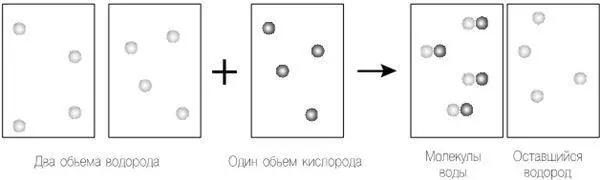
Рисунок 12.1. Следуя теории Гей-Люссака, мы берем два объема водорода, объединяющихся с одним объемом кислорода для создания одного объема водяного пара. Далее мы применяем уравнение Дальтона для объединения объемов. Поскольку объем, давление и температура объемов одинаковы, мы применяем закон Авогадро, сохраняя одинаковое число «частиц», которые в этом случае являются отдельными атомами в каждом объеме.
А именно, давайте предположим, что в водороде и кислороде два отдельных атома объединяются, чтобы сформировать двухатомные молекулы H 2и O 2соответственно, а не просто существуют как отдельные атомы H и O. Теперь вернемся к нашему эксперименту, используя только результаты Гей-Люссака для объединенных объемов и закон Авогадро (рис. 12.2).
Так как мы исключили уравнение Дальтона, мы просто возвращаемся к закону Авогадро и используем одинаковое количество частиц в каждом объеме. Единственное оставшееся у нас требование Гей-Люссака напоминает нам, что все атомы водорода и кислорода превратятся в итоге в водяной пар; другими словами, у нас не может остаться свободных атомов, как было прежде. И вот тут мы наблюдаем нечто интересное. Если мы считаем истинными теории Гей-Люссака и Авогадро, мы видим, что формулой молекулы воды является H 2O — не HO, как считал Дальтон.
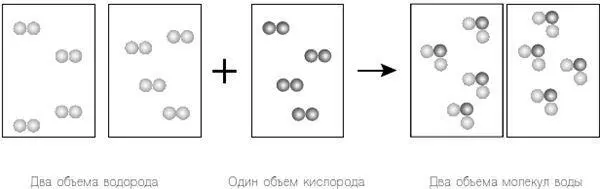
Рисунок 12.2. Еще раз рассмотрим результаты исследований Гей-Люссака вместе с законом Авогадро. Однако на этот раз мы игнорируем уравнение Дальтона и вместо этого предполагаем, что водород и кислород существуют как двухатомные молекулы, H 2и O 2соответственно. Это соответствует теории Гей-Люссака и закону Авогадро, и в результате не остается «лишних» атомов.
Однако мы в некотором смысле сжульничали; в конце концов, мы предположили, что кислород и водород существуют как двухатомные молекулы. Мы знаем, что это действительно так, но во времена Дальтона это было неизвестно. Даже с исключением допущения Дальтона и применением результатов Гей-Люссака с законом Авогадро у нас остается еще множество вариантов. Все, что мы сделали, так это обнаружили один достаточно хорошо (и, как известно сегодня, правильно) работающий принцип. Таким образом, остается вопрос: как мы согласуем все эти методы и результаты?
В то время как закон объемных отношений Гей-Люссака и закон Авогадро решают не только проблему того, как соединяются водород и кислород при образовании воды, они все же вынудили нас отклонить предположение Дальтона о том, как объединяются атомы (правило наибольшей Дальтона). Более того, изучая различные реакции, а не только одну, как это сделали мы, можно достигнуть соответствия между разными реакциями, придя к правильным химическим уравнениям. На самом деле у Авогадро было собственное простое правило. Он утверждал, что верное уравнение для данной химической реакции будет согласовываться с уравнениями других связанных химических реакций, а также результатами Гей-Люссака и его, Авогадро, законом.
Закон Авогадро был совершенно новым взглядом на атомы газа. То, что у газов при равном объеме, температуре и давлении одинаковое количество частиц, будь это атомы или молекулы, также означало, что внутри газа имеется большое количество свободного пространства и что атомы не находятся в постоянном контакте друг с другом. Далее, предполагая, что атомы газа могут объединиться, формируя молекулы, бросало вызов популярной идее, что одинаковые атомы могут только отталкивать друг друга.
Читать дальше
Конец ознакомительного отрывка
Купить книгу














