1 ...6 7 8 10 11 12 ...71 Открытие того, что порядковый номер (положение) элемента в периодической системе, от которого зависят химические свойства элемента, равен как раз числу положительных зарядов в ядре данного атома, вскрыло глубокий смысл системы Менделеева. Нельзя не удивляться гениальной прозорливости великого русского химика, сумевшего за сорок лет до открытия самого существования атомных ядер правильно определить место каждого элемента в открытой им периодической системе.
Строя свою систему, Менделеев располагал элементы в порядке возрастания их атомных весов, так как атомный вес был в то время главным отличительным признаком разных элементов. Но, учитывая все другие свойства аргона, калия, кобальта, никеля, иода и теллура, Менделеев разместил эти элементы с нарушением постепенного возрастания их атомных весов. Так, например, элемент теллур (атомный вес 127,6) Менделеев поставил на 52 место, а иод (атомный вес 126,9) — на 53-е, хотя их следовало бы расположить в обратном порядке, если руководствоваться атомным весом. Многочисленные измерения электрического заряда ядер атомов аргона, калия, кобальта, никеля, иода, теллура и всех других элементов показали, что число «элементарных» зарядов в ядрах атомов элементов точно совпадает с тем порядковым номером, который им дал Менделеев в своей периодической системе.
Таким образом, место элементов в периодической системе объективно обусловлено положительным зарядом их атомных ядер. Тем самым было установлено, что число «элементарных» зарядов в ядре (число Менделеева Z) является самой главной и существенной характеристикой атома, полностью определяющей его химические свойства.
Между положительно заряженным ядром атома и его электронами, как и между всякими разноименно заряженными телами, действуют силы электрического притяжения, удерживающие электроны в обширной оболочке атома. Электроны обращаются в атоме на разных расстояниях от ядра, располагаясь несколькими слоями. В каждом слое может находиться лишь вполне определенное количество электронов. Первый слой, ближайший к ядру, получил название K -слоя; в нем может находиться не более двух электронов. Далее следует второй слой ( L -слой), имеющий не более 8 электронов, третий слой ( M -слой), содержащий не более 18 электронов, и т. д. Под действием сил притяжения со стороны ядра электроны стремятся расположиться в ближайших к ядру слоях. Поэтому при построении электронной оболочки атома сперва заполняется слой K , затем L, М и т. д. Если число электронов в атоме, равное, как мы знаем, Z , меньше того их количества, которое необходимо для заполнения слоев, то последний (верхний) слой остается незаполненным. Строение электронной оболочки некоторых атомов схематически дано на рис. 3. Каждый слой условно изображен окружностью, на которых точками показаны электроны.
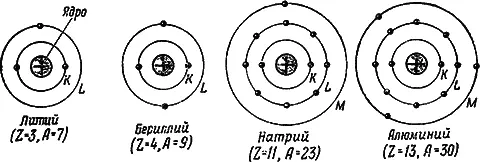
Рис. 3.Строение электронной оболочки некоторых атомов
В каждой клетке таблицы Менделеева (см. рис. 1), помимо атомного номера и атомного веса, приведены колонки цифр, указывающих распределение электронов по слоям. Для алюминия, например, найдем следующие цифры (снизу вверх): 2, 8, 3, дающие число электронов соответственно в слоях K, L и М; для меди — 2, 8, 18, 1 и т. д.
Первоначально ученые считали, что электроны в атоме вращаются вокруг ядра совершенно так же, как планеты, в том числе и наша Земля, обращаются вокруг Солнца. Атом рассматривали как солнечную систему в миниатюре.
Однако развитие науки показало, что наряду с некоторым сходством между атомом и солнечной системой существует громадное качественное различие. Движение электронов в атоме значительно сложнее, и поэтому, строго говоря, уподоблять атом солнечной системе нельзя.
Наиболее удаленный от ядра внешний слой электронов удерживается ядром с наименьшей силой. Поэтому атомы могут терять один или несколько электронов именно из внешнего слоя. Чем дальше от ядра находятся внешние электроны, способные отрываться от атома, тем легче объединяются они с электронами других атомов при химических взаимодействиях. Химическая активность элементов, их способность участвовать в различных химических процессах определяется именно внешними электронами.
Если из нейтрального атома удалить (выбить) один из его электронов, то, лишенный электрона, атом окажется положительно заряженным. Такой заряженный атом называется положительным ионом. Электрон, выбитый из атома и существующий либо свободно, либо присоединившись к какому-либо атому, образует отрицательный ион. Процесс удаления электрона из атома, в результате которого образуется пара ионов, называется ионизацией.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













