Каждый химический элемент имеет в периодической системе строго определенное место с определенным порядковым номером, называемым числом Менделеева, или атомным номером. Водород, открывающий таблицу, имеет номер 1, гелий — 2, уран — 92 и т. д. Атомный номер набран в таблице (рис. 1) крупным жирным шрифтом. Там же под наименованием элементов приведены их атомные веса. С возрастанием атомного номера свойства элементов периодически изменяются. Зная место элемента в периодической таблице, можно указать его основные свойства.
Атомный номер Z и атомный вес А — это основные величины, которыми характеризуются атомы каждого элемента.
Из периодического закона следует, что атомы различных элементов внутренне связаны между собой и поэтому, отличаясь друг от друга, они должны в то же время иметь что-то общее, дающее им возможность к изменениям и превращениям друг в друга. Отсюда получается, что атомы не могут быть простыми и неизменными шариками с раз и навсегда данными свойствами, а должны иметь сложное строение.
Новый взгляд на атом, как на качественно своеобразную материальную систему, не являющуюся чем-то простым и неизменным, был сформулирован Ф. Энгельсом раньше, чем это сделали сами физики и химики, а в дальнейшем развит В. И. Лениным. Энгельс указывал, что атомы «отнюдь не являются чем-то простым, не являются вообще мельчайшими известными нам частицами вещества» [4] Ф. Энгельс. Диалектика природы, 1952 г., стр. 216.
.
Важнейшими открытиями, доказавшими сложность атома и тем самым подтвердившими взгляды Ф. Энгельса и подготовившими создание современной теории атома, явились открытия электрона(1897 г.) и радиоактивности(1896–1898 гг.).
Обобщая результаты науки начала XX столетия и критикуя старое метафизическое понимание атома как неизменной и неделимой частицы вещества, Ленин говорил, что диалектический материализм признает неисчерпаемость атома и утверждает, что «электрон так же неисчерпаем, как и атом, природа бесконечна…» [5] В. И. Ленин. Соч., т. 14, стр. 249.
Ленинское учение о неисчерпаемости материи во всех ее частях и проявлениях, полностью подтвержденное последующим развитием науки, имеет важное значение для прогресса современной атомной физики.
4. Строение атома
По современным представлениям, в формировании которых большую роль сыграли работы великого английского физика Э. Резерфорда, атом состоит из тяжелого положительно заряженного ядра, обладающего очень малыми размерами, и легких электронов, движущихся вокруг ядра в обширной области, получившей название электронной оболочки(рис. 2).
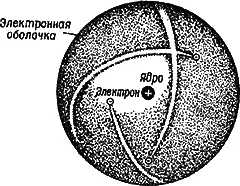
Рис. 2.Строение атома
Диаметр ядра в несколько десятков тысяч раз меньше диаметра атома. Если представить себе атом увеличенным до размеров высотного здания Московского университета на Ленинских горах, то ядро представится тогда в виде вишни средней величины.
Электрон — мельчайшая частица вещества, обладающая зарядом отрицательного электричества. Вес (масса) электрона очень мал; он примерно в 1840 раз меньше веса легчайшего из всех атомов — атома водорода. Электрический заряд, меньший чем у электрона, никогда не наблюдался. Поэтому в атомной физике принято все заряды измерять в зарядах электрона.
Число электронов в электронной оболочке атома равно числу положительных зарядов в его ядре. Благодаря одинаковому числу положительных и отрицательных зарядов атом в целом нейтрален, то есть электрически не заряжен.
Положительный заряд ядер атомов различных химических элементов не одинаков: заряд ядра, а следовательно, и число обращающихся вокруг него электронов равны порядковому номеру элемента Z в периодической системе Менделеева. Так, например, атом водорода состоит из ядра, имеющего один заряд положительного электричества и движущегося вокруг него одного электрона. Соответственно этому водород стоит на первом месте в периодической системе. Атом гелия состоит из ядра, имеющего двойной положительный заряд, и движущихся вокруг него двух электронов. Гелий расположен в периодической системе на втором месте. В атоме кислорода имеется 8 положительных зарядов в ядре и 8 электронов в оболочке. Соответственно этому кислород занимает в системе Менделеева восьмое место.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













