Этот гальванический элемент назвали элементом второго рода, или аккумулятором. Как же происходит накопление энергии в аккумуляторе Плантэ? При пропускании тока через электролит из серной кислоты на свинцовой пластине, соединенной с отрицательным полюсом источника тока – катодом, выделяется водород, который восстанавливает окись свинца в чистый свинец. На электроде, соединенном с положительным полюсом – анодом, выделяется кислород, который окисляет окись свинца до перекиси. Аккумулятор зарядится, когда катод целиком станет чистым свинцом, а анод – перекисью свинца. Тогда между электродами окажется наибольшее напряжение.
Соединяя пластины-электроды проводником с потребителем, расходуя энергию, мы разряжаем аккумулятор. Направление тока при разрядке противоположно тому, что было при зарядке. Положительно заряженная пластина будет восстанавливаться водородом, а отрицательная – окисляться кислородом. Как только пластины станут одинаковыми, аккумулятор прекратит давать ток. Надо повторить зарядку.
Ясно, что энергия в этом аккумуляторе накапливается в виде вполне осязаемого вещества – свинца, переходящего с выделением энергии в перекись свинца. Сам процесс накопления и выделения энергии здесь происходит иначе, чем в чисто электрических аккумуляторах – конденсаторах. Поэтому такой аккумулятор принято называть электрохимическим.
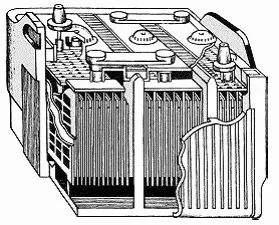
Рис. 322. Автомобильный свинцово-кислотный аккумулятор
В конструкциях автомобильных свинцово-кислотных аккумуляторов (рис. 322) ученые постарались как можно больше увеличить поверхность электродов, не нарушая при этом их прочности. Ведь именно от величины поверхности зависит мощность аккумулятора. Сейчас пластины аккумулятора изготовляются в форме свинцовых решеток, покрытых перекисью свинца (положительный электрод) и губчатым свинцом (отрицательный электрод). Электролитом служит 25—35%-й водный раствор серной кислоты. Заряженный автомобильный аккумулятор имеет напряжение (точнее – электродвижущую силу) на клеммах 2 – 2,2 В. При разрядке это напряжение падает, и когда оно достигает 1,8 В, разрядку обычно прекращают, иначе решетка из свинца может слишком истончиться в ходе реакции, и пластины, потеряв прочность, рассыплются.
Вы хотите узнать, что будет с аккумулятором, если попробовать хотя бы кратковременно получить от него ток большой мощности? Тогда включите стартер, питаемый от аккумулятора, но без подачи топлива в двигатель. Двигатель, естественно, не заведется, а через 15—20 секунд стартер начнет сбавлять обороты. Еще через некоторое время он вообще остановится. Будет полное впечатление, что аккумулятор разрядился и больше из него «выжать» ничего нельзя. Но потом, спустя несколько минут, стартер снова заработает! Откуда берутся силы у аккумулятора? Не может же он, как живое существо, отдыхать?
В самом деле, поведение аккумулятора и живого организма здесь поразительно похожи. При усталости мышц от интенсивной работы их сила резко снижается, и нужно время, чтобы она восстановилась. Человек сделает гораздо больше, если он будет работать равномерно, с постоянной, но небольшой по мощности нагрузкой. Например, если попытаться взбежать на 20-й этаж дома, с одного раза это вряд ли получится, потребуется отдых. Да и усталость после этого будет ощущаться немалая. А если идти спокойно, то 20 этажей можно преодолеть без особой усталости.
Так и в аккумуляторе: при включении его на большую мощность серная кислота, которая была в порах пластин, быстро израсходуется, в результате реакции она превратится в воду, и выделение тока прекратится. Только через некоторое время, когда серная кислота постепенно вновь заполнит поры, можно опять разряжать аккумулятор.
Поэтому разряжают и заряжают аккумуляторы (это касается практически всех видов электрохимических аккумуляторов) обычно с достаточно малой нагрузкой, небольшими токами и продолжительное время – несколько часов. Здесь и кроется один из главнейших недостатков электрохимических аккумуляторов – их малая мощность, приходящаяся на 1 кг массы аккумулятора, так называемая удельная мощность, или плотность мощности.
Свинцово-кислотные аккумуляторы весьма экономичны, однако они и капризны, часто портятся, недолговечны. К тому же свинец – сравнительно редкий и дорогой металл, а кислота опасна в обращении. Естественно, что ученые стали искать новые материалы и новые принципы работы аккумуляторов. Так возник второй основной тип электрохимических аккумуляторов – щелочные аккумуляторы. Создание их тесно связано с именем знаменитого американского ученого и изобретателя Томаса Эдисона (1847—1931).
Читать дальше
Конец ознакомительного отрывка
Купить книгу









