Для Земли и человека вода — самое главное. Благодаря указанному свойству воды и сохраняется неизменным или маломеняющимся тепловое состояние планеты. Значит, вода стабилизирует климат Земли. Это мы подробно рассмотрели в книге «Озонные дыры и гибель человечества?».
Любопытно, что переход вещества из одного фазового состояния в другое может быть задержан. Так, можно задержать кристаллизацию в переохлажденной жидкости. Известно, что переохлажденная жидкость с понижением температуры становится все плотнее и плотнее. Но при этом она все же не превращается в твердое тело в собственном смысле этого слова. Как ни странно это звучит, такой переохлажденной жидкостью является стекло. Стекло течет, это доказывает то, что старинные оконные стекла внизу толще, чем в верхней части. Собственно, переохлажденная жидкость отличается от твердого тела тем, что она не имеет четко выраженной точки (температуры) плавления. Когда переохлажденная жидкость поглощает тепло, она не переходит в жидкое нормальное состояние резко, а постепенно размягчается.
Что же касается истинных твердых тел, то они бывают макро- и микрокристаллическими. В микрокристаллических твердых телах кристаллы слишком малы, для того чтобы их можно было увидеть невооруженным глазом.
Когда образуются кристаллы, то молекулярные структуры в них исчезают. При этом атомы образуют сравнительно крупную решетку. Это можно видеть на рисунке 1, где изображено вольфрамовое острие диаметром около 150 ангстрем. Один ангстрем равен одной стотысячной доле миллиметра. Кристаллическая решетка может меняться в зависимости от давления и температуры. Примером разных кристаллических решеток могут служить алмаз и графит, которые являются модификациями углерода.
Обычная соль NaCl состоит из кристаллов, в которых атомы образуют правильную решетку. Сейчас такие решетки изучают с помощью электронного микросита. Силикаты образуют самые различные кристаллы весьма сложной структуры. В определенных условиях кристаллы любого вещества
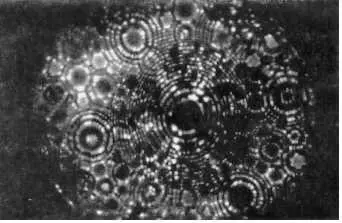
Рис. 1. Фотография изображения вольфрамового острия диаметром около 150 е Среднее увеличение в 2,5 миллиона раз — вающая расположение атомов в металле.
имеют строго определенную форму. Это напоминает живой организм. В сущности, они тоже растут, пристраивая к своей поверхности новые решетки из молекул, которые они извлекают из окружающей среды. Этот процесс очень непростой. Он создает сам себя (растет) из материала, который содержится в окружающей среде. Поэтому и возникает аналогия между кристаллом и живым веществом. Когда органическая молекула действует как шаблон при самокопировании или самовоспроизведении, то происходит точно такой же процесс. Ведь кристаллизация родственна химическому процессу полимеризации, при котором одинаковые молекулы соединяются в цепочки большого молекулярного веса. Вполне можно рассматривать кристалл как одну молекулу полимера.
Простой вариант полимеризации реализуется, когда сложные молекулы образуются из атомов одного сорта. Мы говорили о кислороде в виде О, О2, О3 и О4. Формально это можно считать начальной стадией кристаллизации. Она не имеет своего продолжения только потому, что температура для этого очень высокая, а давление слишком мало.
Уникальным является углерод. Его атомы способны объединяться друг с другом и образовывать цепочки. Можно сказать, что органическая химия является химией углерода. Если к углероду добавить его соединения с водородом, то получается практически вся органическая химия. Да, собственно, деление химии на органическую и неорганическую весьма условно и не всегда целесообразно. Правда, с точки зрения решения проблемы жизни на Земле такое деление себя оправдывает.
К проблеме жизни причастна органическая химия. Суть органической химии начинают изучать с парафинового ряда углеводородов. Это СН4, С2Н6, С4Н10… СnH2n+2. Записанные формулы изображают в следующем виде:
Бутан и изобутан имеют одинаковую формулу С4Н10. Они отличаются только пространственным расположением атомов в молекуле и своими свойствами. Свойства их настолько разнятся, что их можно считать разными веществами. Их называют изомерами.
Что касается парафинов, то это простейшие углеводороды. Это соединения с цепным строением. В них повторяется группа атомов с двумя свободными валентностями, которые способны образовывать связи.
Читать дальше












