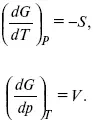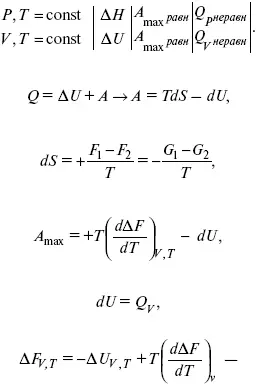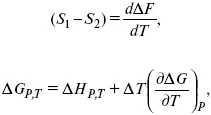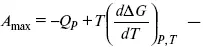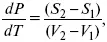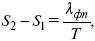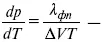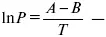1 ...6 7 8 10 11 12 ...47 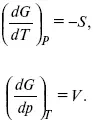
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (Δ G ) P,T < 0. Для несамопроизвольного процесса: (Δ G ) P,T > 0. Для равновесного процесса: ( Δ G) P,T= 0
Δ G (P, T)≤ 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия.
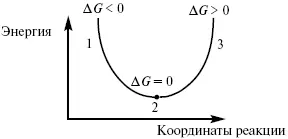
Рис. 5
где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет Δ U и Δ H .
Противодействующие факторы.Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
H = U + PV,
dH = dU + pdv + vdp,
U = TS – PV,
dU = TdS – SdT + pdV + Vdp,
dH = –pdV + pdV + Vdp; U = TdS + VdP.
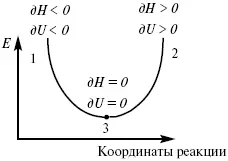
Рис. 6
где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
(dH) P,T≤ 0,
(dU) S,T≤ 0.
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы.
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса
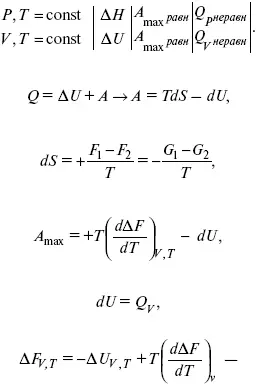
уравнение Гельмгольца (уравнение связывающее функции F и G с их температурными производными).
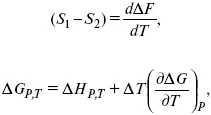
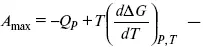
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
U 2– U 1= T(S 2– S 1) – P(V 2– V 1),
(U 1– TS 1+ PV 1) = (U 2– TS 2+ PV 2),
G 1= G 2– в условиях равновесия.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза => dG 1= V 1dp – S 1dT.
II фаза => dG 2= V 2dp – S 2dT, при равновесии dG 2– dG 1= 0
dG 2– dG 1= dp(V 2– V 1) – dT(S 2– S1) –
нет условного равновесия,
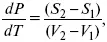
где dP/dT – температурный коэффициент давления,
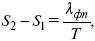
где λ фп– теплота фазового перехода.
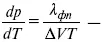
уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
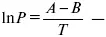
эмпирическая форма уравнения Клаузиуса-Клапейрона.
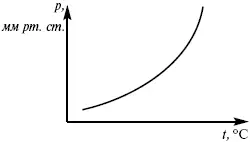
Рис. 7
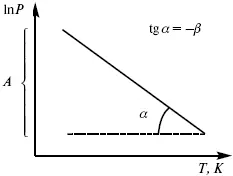
Рис. 8
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями S и V.
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
Читать дальше
Конец ознакомительного отрывка
Купить книгу