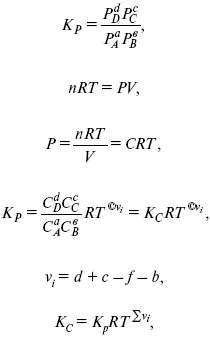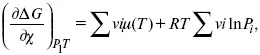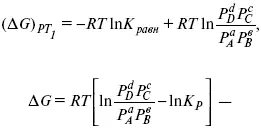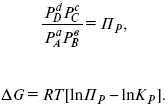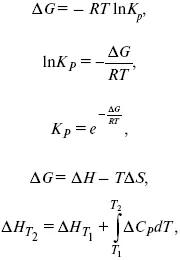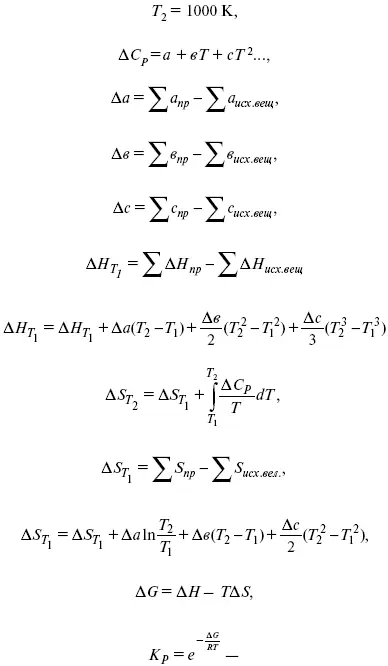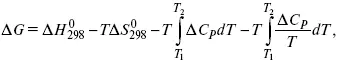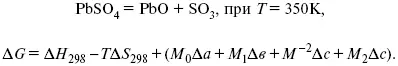А. Березовчук - Физическая химия - конспект лекций
Здесь есть возможность читать онлайн «А. Березовчук - Физическая химия - конспект лекций» — ознакомительный отрывок электронной книги совершенно бесплатно, а после прочтения отрывка купить полную версию. В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Город: Москва, Год выпуска: 2009, Издательство: Array Конспекты, шпаргалки, учебники «ЭКСМО», Жанр: Физика, на русском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:Физическая химия: конспект лекций
- Автор:
- Издательство:Array Конспекты, шпаргалки, учебники «ЭКСМО»
- Жанр:
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг книги:3 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
Физическая химия: конспект лекций: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «Физическая химия: конспект лекций»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.