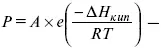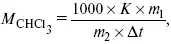Если растворить в ста миллилитрах водопроводной воды 10 г едкого натра NaOH, то температура резко повышается до 60 oС (температура воды из водопроводного крана +20 oС).
Если растворить 40 г нитрата аммония NH 4NO 3в 100 мл этой же воды, то температура резко понижается от +20 oС до –7 oС.
Если растворить хлорид натрия NaCl в 100 мл водопроводной воды, то температура не изменяется.
3. Растворимость газов в жидкостях
Она зависит от давления и температуры. Растворимость газов неодинакова из-за различной химической природы.
Пример:
N 2, H 2– мало растворимы в воде, растворимость NH 3, HCl очень велика, в одном объеме H 2O растворяется 700 объемов аммиака NH 3.
Газ + H 2O → 3,5 объема О 2в одном объеме Н 2О экзотермический процесс. С повышением температуры растворимость некоторых газов уменьшается. При постоянной температуре и невысоком давлении растворимость газов, не вступающих в химическое взаимодействие с растворителем, подчиняется закону Генри – Дальтона, который состоит из нескольких частей.
1 часть:масса газа, растворяющаяся в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость.
Например, CO 2под давлением загоняем в бутылку.
2 часть:объем газа не зависит от давления.
3 часть:если смесь газов растворять, то растворимость каждой составной части пропорциональна своему парциальному давлению.
Газы, реагирующие с водой, не подчиняются закону Генри – Дальтона.
4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов– частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть P BO – давление пара над чистым растворителем, при постоянной температуре T 1; P B – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В :
P B = f ( T ).
Разность P BO – P B равна понижению давления пара.
Величина (P BO– P B) /P BO – относительное понижение упругости пара = X A= Δ P/P BO , где X A – мольная доля, P BO> P B, Δ P = P BO– P B – абсолютное понижение упругости пара.
Закон Рауля.Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
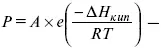
барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
Δ t кип=Э x С моляльн,
где Э – эбуллиоскопическая константа, +0,52.
Δ t зам=К x С моляльн,
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа– разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа– разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl 3) рассчитывается по формуле:
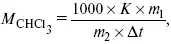
где m 1– масса растворенного вещества;
m 2– масса растворителя;
Δ t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Осмос– явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков, например, ферроцианида меди Cu 2[Fe(CN) 6]; этот осадок образуется в порах перегородки стеклянного фильтра при погружении пористого материала сначала в раствор медного купороса (CuSO 4x 5H 2O), а затем желтой кровяной соли K 2[Fе(CN) 6] . Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое дав-ление, т. е. осмотическое давление– мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора.
Читать дальше
Конец ознакомительного отрывка
Купить книгу