Таблица 2.
АТОМНЫЕ ВЕСА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Водород … 1,00797
Гелий … 4,0026
Литий … 6,939
Бериллий … 9,0122
Бор … 10,811
Углерод … 12,01115
Азот … 14,0067
Кислород … 15,9994
Фтор … 18,9984
Неон … 20,183
Натрий … 22,9898
Магний … 24,312
Алюминий … 26,9815
Кремний … 28,086
Фосфор … 30,9738
Сера … 32,064
Хлор … 35,453
Калий … 39,102
Аргон … 39,948
Кальций … 40,08
Скандий … 44,956
Титан … 47,90
Ванадий … 50,942
Хром … 51,996
Марганец … 54,9380
Железо … 55,847
Никель … 58,71
Кобальт … 58,9332
Медь … 63,54
Цинк … 65,37
Галлий … 69,72
Германий … 72,59
Мышьяк … 74,9216
Селен … 78,96
Бром … 79,909
Криптон … 83,80
Рубидий … 85,47
Стронций … 87,62
Иттрий … 88,905
Цирконий … 91,22
Ниобий … 92,906
Молибден … 95,94
Рутений … 101,07
Родий … 102,905
Палладий … 105,4
Серебро … 107,870
Кадмий … 112,40
Индий … 114,82
Олово … 118,69
Сурьма … 121,75
Йод … 126,9044
Теллур … 127,60
Ксенон … 131,30
Цезий … 132,905
Барий … 137,34
Лантан … 138,91
Церий … 140,12
Празеодим … 140,907
Неодим … 144,24
Самарий … 150,35
Европий … 151,96
Гадолиний … 157,25
Тербий … 158,924
Диспрозий … 162,50
Гольмий … 164,930
Эрбий … 167,26
Тулий … 168,934
Иттербий … 173,04
Лютеций … 174,97
Гафний … 178,49
Тантал … 180,948
Вольфрам … 183,85
Рений … 186,2
Осмий … 190,2
Иридий … 192,2
Платина … 195,09
Золото … 196,967
Ртуть … 200,59
Таллий … 204,37
Свинец … 207,19
Висмут … 208,980
Торий … 232,038
Уран … 238,03
В середине XIX века предпринимались попытки найти такой порядок среди химических элементов. Элементов становилось все больше, их атомные веса измерялись все с большой точностью, и ученым показалось логично занести элементы в таблицу в порядке увеличения их атомных весов (как в табл. 3) и посмотреть, что же из этого получится.
Таблица 3.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ

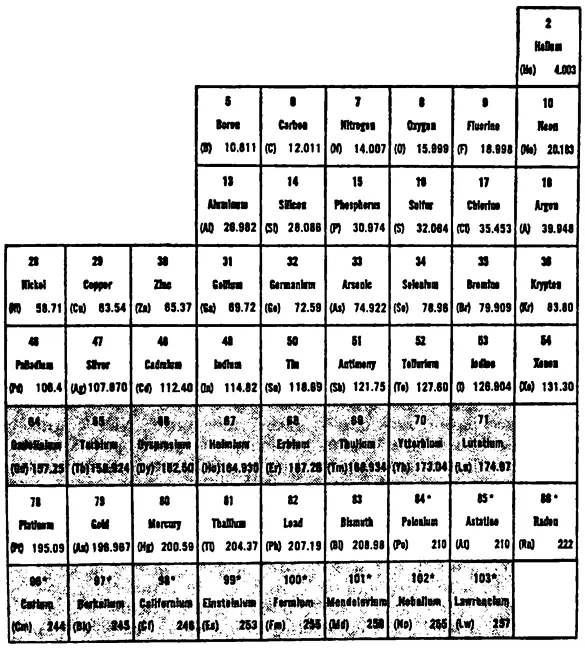
Было несколько попыток создать такую таблицу, но успехом увенчалась лишь одна. В 1869 году русский химик Дмитрий Иванович Менделеев (1834–1907) расположил все известные на тот момент химические элементы в таблицу по рядам и колонкам так, что элементы со сходными свойствами попадали в одну колонку (или ряд, смотря как расположить таблицу). Свойства элементов одной колонки повторялись с определенной периодичностью, поэтому таблица получила название периодическая.
Сложности возникли из-за того, что науке были известны далеко не все химические элементы. Когда Менделеев заносил элементы в колонки своей таблицы согласно их свойствам, ему пришлось оставлять пустые клетки. В 1871 году он объявил, что в этих клетках должны быть еще неоткрытые элементы, и, приводя средние значения элементов сверху и снизу пустой клетки, довольно точно предсказал свойства неизвестных элементов.
В течение 15 лет были открыты все три обозначенных Менделеевым элемента, и их свойства в точности совпадали с его предсказаниями. В результате в 1880 году периодическая таблица Менделеева была принята в качестве путеводителя по неизведанному миру химических элементов, и до сих пор от нее никто не собирается отказываться. Открытия более поздних лет (см. гл. 4) лишний раз подтвердили верность периодической системы. Д.И. Менделеев пришел к своему открытию эмпирическим путем, то есть стало понятно, что периодическая таблица верна и работает, но никто не знал, почему она работает. Ответ был найден в XX веке.
Таблица 3 и есть общепринятая современная периодическая система. Элементы расположены в порядке возрастания атомного веса (есть, правда, три исключения, которые я поясню чуть ниже), и каждый элемент имеет свой порядковый номер — от 1 до 103. Значение этого «атомного номера» мы обсудим чуть ниже.
Сравнивая табл. 3 и табл. 2, можно заметить следующее. Для того чтобы поместить все элементы в нужные ряды, придется поставить три элемента не по порядку. У элемента 18 (аргон) порядковый номер ниже, чем у элемента 19 (калий), несмотря на то что атомный вес у аргона больше. Точно так же у элемента 27 (кобальт) атомный вес больше, чем у элемента 28 (никель), и у элемента 52 (теллур) атомный вес выше, чем у элемента 53 (йод). Поскольку разница в весе очень мала, то ученые в XIX веке не обращали особого внимания на несколько незначительных исключений из общего правила. Однако ученые XX века выяснили, что эти исключения крайне важны (см. ниже).
Читать дальше














