Оставалось неясным, каким образом, с использованием этих механизмов, информация о состоянии активности могла бы передаваться при клеточном делении; была, таким образом, неясна их роль в эпигенетической передаче информации. Следующим важным шагом стало понимание того, что модифицированные гистоны рекрутируют специфичным в отношении данной модификации образом белки, которые могут влиять на локальные структурные и функциональные состояния хроматина. Было, например, обнаружено, что метилирование лизина 9 в гистоне H3 приводит к рекрутированию белка НР1 гетерохроматина (Bannister et al., 2001; Lachner et al., 2001; Nakayama et al., 2001). Более того, HP1 мог рекрутировать энзим (Suv39hl), отвечающий за метилирование. Это привело к созданию модели воспроизведения сайленсированного состояния хроматина по всему данному участку посредством процессивного [processive] механизма (рис. 2.1а). В равной степени важно, что это обеспечило разумное объяснение того, каким образом это состояние может быть передано и сохранено в цикле репликации (рис. 2.16). Были предложены аналогичные механизмы для воспроизведения активного состояния, включающие метилирование лизина 4 в гистоне H3 и рекрутирование белков группы Trithorax (Wysocka et al., 2005).
Были предложены различные типы механизмов воспроизведения, которые зависели не от модифицированных, а от вариантных гистонов (Ahmad and Henikoff, 2002; McKittrick et al., 2004). Гистон H3 включается в хроматин только во время репликации ДНК. Напротив, вариант этого гистона, H3.3, отличающийся от H3 четырьмя аминокислотами, включается в нуклеосомы не зависящим от репликации образом и имеет тенденцию накапливаться в активном хроматине, где он обогащается «активными» модификациями гистонов (McKittrick et al., 2004). Предположили, что для поддержания активного состояния достаточно присутствия H3.3 и что после репликации остается достаточно H3.3 для поддержания активного состояния, хотя он и разбавляется вдвое. Последующая транскрипция приводила бы к замещению нуклеосом, содержащих H3, вариантом H3.3, воспроизводя таким образом это активное состояние в следующем поколении.
6. Все механизмы взаимосвязаны
В этих моделях в конечном счете начала замыкаться связь между модифицированными или вариантными гистонами, активацией специфических генов и эпигенетикой, хотя, конечно, многое еще остается сделать. В то время как эти механизмы дают нам какие-то представления о том, как состояние гетерохроматина может поддерживаться, они не объясняют, каким образом структуры «молчащего» хроматина устанавливаются впервые. Лишь недавно стало ясно, что это связано с продукцией РНК-транскриптов, особенно с повторяющихся последовательностей, которые подвергаются процессингу в малые РНК благодаря действию таких белков, как Dicer, Argonaute и РНК-зависимая РНК-полимераза. Впоследствии эти РНК рекрутируются в гомологичные сайты ДНК как часть комплексов, включающих компоненты группы белков Polycomb, инициируя таким образом формирование гетерохроматина. Сейчас имеются также данные о том, что для поддержания по крайней мере некоторых гетерохроматиновых районов требуются те же механизмы. В известном смысле эти устойчивые циклические цепи реакций напоминают предложенную Дельбрюком модель 50-летней давности — модель устойчивого биохимического цикла, поддерживающего данное состояние организма.
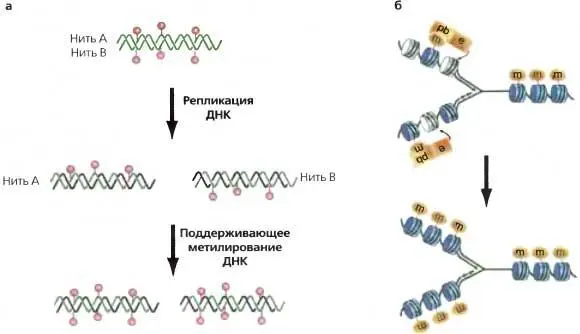
Рис. 2.1.Механизмы поддержания паттерна метилирования ДНК и модификаций гистонов в ходе репликации ДНК
(а) механизм поддержания паттерна метилирования ДНК в ходе репликации ДНК. Во время репликации отдельные нити ДНК, со специфическим паттерном метилирования в остатках CpG или CpXpG, спариваются с нитью вновь синтезированной, неметилированной ДНК. CpG на одной нити имеет соответствующий CpG на другой. Поддерживающая ДНК-метилтрансфераза распознает полуметилированный сайт и метилирует цитозин на новой нити, так что паттерн метилирования не нарушается; (б) общий механизм для поддержания модификаций гистонов в ходе репликации. Модифицированный гистоновый «хвост» (m) взаимодействует с белком-связкой (pb — a protein binder), имеющим сайт связывания, специфичный для данной модификации, pb. в свою очередь, имеет специфический сайт для энзима (е), который выполняет эту модификацию гистона, т. е. в свою очередь, может затем модифицировать соседнюю нуклеосому. Во время репликации вновь откладывающиеся гистоны, которые перемежаются с родительскими гистонами, могут таким образом приобретать данную родительскую модификацию. Сходный механизм мог бы обеспечить воспроизведение, распространение модификаций гистонов с модифицированного на немодифицированный участок на любой стадии клеточного цикла
Читать дальше