Обменная емкость измеряется в молях ионов, обмениваемых в 1 м 3ионита в его влажном (набухшем) состоянии: моль/м 3или ммоль/л. Так, например, если обменная емкость ионита равна 800 моль/м 3, это означает: 1 м 3такого ионита может извлечь 800 моль ионов. Иногда обменную емкость выражают в молях ионов на 1 кг воздушно-сухого ионита – моль/кг.
Ионообменные смолы представляют собой специально синтезированные полимерные вещества, нерастворимые в воде, чаще всего – получаемые сополимеризацией полистирола или полиакрилата с дивинилбензолом (ДВБ). В полученный сополимер вводят функциональные группы с подвижным катионом – ионогенные группы, способные вступать в обменные реакции.
По структуре полимерного каркаса ионообменные смолы делятся на две группы: гелевые (непористые) и макропористые.
Гелевые иониты проявляют ионообменные свойства только в набухшем состоянии, в этих условиях их объем увеличивается в 1,5–3 раза. При набухании гелевого ионита его гранула как бы раскрывает скрытые в сухом ионите поры. Структура гелевого ионита в двухмерном и внемасштабном изображении показана на рис. 2, а, б. Удельная площадь поверхности пор у гелевых ионитов – не более 5 м 2в 1 г ионита, а размер ячеек (условно – пор) – 0,5–2,0 нм.
В последние годы больше производят макропористые иониты, мало набухающие, но, вследствие изначально развитой поверхности пор, очень активные в сорбционных и обменных реакциях. Удельная площадь поверхности пор макропористых ионитов – 20–130 м 2/г ионита. Средний диаметр пор – 20–100 нм. Их структура представлена на рис. 2.16, в.
Ионообмен в макропористых ионитах проходит быстрее, чем в гелевых. Путь в порах, который должен пройти ион до встречи с активной группой матрицы, примерно одинаков: в макропористых ионах – до 100 мкм, в гелевых – до 500 мкм.
Поры гелевых ионитов имеют естественное происхождение, а макропористых – образованы введенными при синтезе ионитов спиртами, гептаном и жирными кислотами, которые впоследствии удаляются.
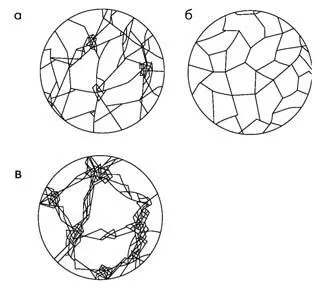
Рис. 2. Схема структуры сеток у различных видов полимерных ионитов (реальный масштаб не учитывается): а – обычный неоднородносетчатый («гетеропористый») ионит; б – однородносетчатый («изопористый») ионит; в – явнопористый («макропористый») ионит
Кроме обменной емкости, каждый ионит характеризуется многими параметрами, отвечающими за физические свойства, его химическую и термическую стабильность. Существует оптимальное соотношение среднего размера гранул и толщины слоя для различного применения. Уменьшение размера зерна-гранулы ионита (в пределе – до порошкообразного состояния, размер частиц – 0,04–0,07 мм) приводит к увеличению гидравлического сопротивления до неприемлемых значений. Например, намывные фильтры формируются из порошкообразного ионита; толщина слоя должна быть ограничена 3–10 мм. Оптимальные размеры зерен катионита, исходя из этих соображений, принимают в пределах 0,3–1,5 мм.
Картриджи на основе ионообменной смолы
В настоящее время на рынке представлены ионообменные смолы российских и иностранных производителей, которые применяются в картриджах для умягчения воды. Конструктивно картриджи изготовлены таким образом, что провести регенерацию ионообменной смолы невозможно. Если используется ионообменная смола на основе гельсополимерстирола или дивинилбензола, то емкость по солям жесткости для 10-дюймового картриджа составляет 1000 мг-экв, а для 20-дюймового – около 2000 мг-экв. Некоторые современные картриджи имеют емкость по солям жесткости 10 000 мг-экв. Однако даже их хватит на очистку только 5000–7000 л воды. Поэтому советуем ставить ионообменные или полифосфатные картриджи только на линию для подготовки горячей воды в индивидуальных системах водоснабжения.

Картриджи для обезжелезивания
Подземная вода, в которой содержится железо, прозрачна и чиста на вид. Однако даже при непродолжительном контакте с кислородом воздуха железо окисляется, придавая воде желтовато-бурую окраску. Уже при концентрациях железа выше 0,5 мг/л такая вода способна вызвать появление ржавых потеков на сантехнике и пятен на белье при стирке. При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, у нее ощущается характерный металлический привкус. Все это делает такую воду неприемлемой как для технического применения, так и для питья. Железо не позволяет нормально заварить чай или кофе, делать соки, компоты, квас, а при больших концентрациях – негативно влияет на здоровье. Высокие концентрации железа в воде вызывают аллергические реакции, могут привести к заболеваниям крови. Если железа больше 1 мг/л – желтеет кожа, волосы блекнут и теряют естественный цвет, седые и светлые пряди становятся рыже-коричневыми. При концентрации 10 мг/л волосы можно испортить за две-три недели, и никакие шампуни уже не помогут.
Читать дальше
Конец ознакомительного отрывка
Купить книгу










![Николай Торицын - Краткое руководство по добыче и очистке воды в природных условиях [Учебное пособие]](/books/437851/nikolaj-toricyn-kratkoe-rukovodstvo-po-dobyche-i-och-thumb.webp)



