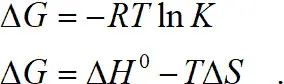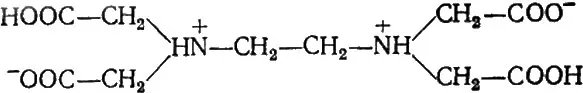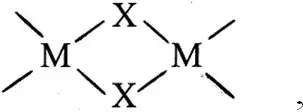
где X ≡ OH -, NH 2 -, Cl -.
Среди факторов, которые влияют на устойчивость комплексов, необходимо отметить следующие:
1. дентатность лиганда: комплексы с полидентатными лигандами более устойчивы, чем с монодентатными;
2. размер хелатного цикла: наибольшей устойчивостью обладают пяти– и шестичленные циклы;
3. пространственные факторы;
4. резонансные эффекты.
Количественную оценку образующихся комплексных соединений можно сделать сравнивая их константы устойчивости. Рассмотрим устойчивость комплексных соединений меди с лигандами различной дентатности, включающие в состав аминные группы:

Увеличение устойчивости комплекса с увеличением дентатности лиганда называют хелатным эффектом ХЭ: 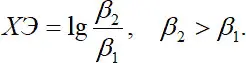 (1.15)
(1.15)
Рассмотрим образование комплексов меди с аммиаком и этилендиамином (NH 2C 2H 4NH 2, введем обозначение en):
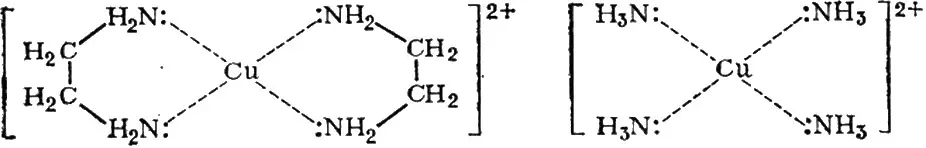
[Cu(H 2O) 4] 2++ 4NH 3↔ [Cu(NH 3) 4] 2++ 4H 2O (1)
[Cu(H 2O) 4] 2++ 2 en ↔ [Cu( en ) 2] 2++ 4H 2O (2)
Устойчивость комплексного соединения симбатна количеству образующихся циклов. Играет роль энергетика и пространственная организация связи.
Энергия Гиббса 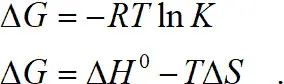
Теплота образования ΔH практически одинакова при образовании связи, как для аммиака, так и для этилендиамина, т. к. в обоих случаях образуется связь через азот. Поэтому энтальпийная составляющая отличается незначительно. Следовательно, дело в энтропийном факторе, который характеризуется изменением числа степеней свободы системы:

Таким образом, во второй реакции наблюдается увеличение числа частиц в системе, рост энтропии, что приводит к росту устойчивости данного соединения и выражается в конечном счете хелатным эффектом.
Более того, существует выигрыш в кинетике процесса. Рассмотрим две реакции с участием в качестве лигандов аммиака и этилендиамина.
M + 2NH 3↔ M (NH 3) 2(1)
M + en ↔ M ( en ) (2)
Если рассматривать механизм, учитывая ступенчатое комплексообразование, то образование соединений по обеим реакциям происходит в две стадии:
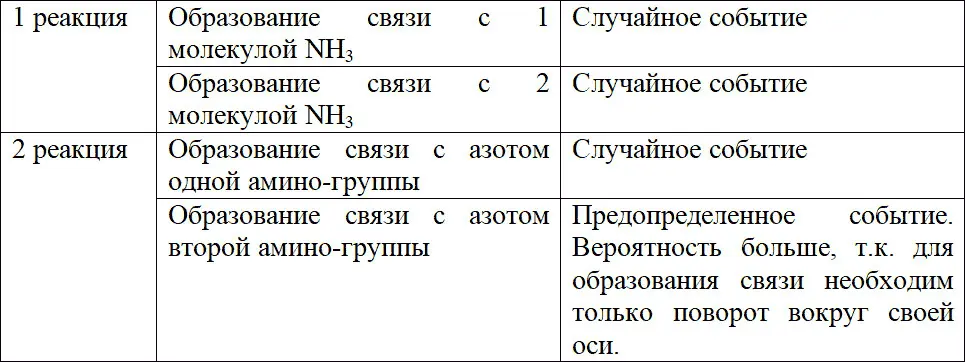
Таким образом, одним из преимуществ применения хелатных соединений является высокая кинетика по сравнению с образованием комплексных соединений с монодентатными лигандами.
Наиболее часто и широко применяются хелатные соединения, сочетающие функциональные группы карбоновых кислот с аминогруппами, – комплексоны. Наиболее известен из них комплексон III (трилон Б), представляющий собой двунатриевую соль этилендиаминтетрауксусной кислоты:
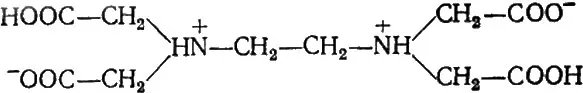
Чрезвычайно высокая устойчивость комплексных соединений с комплексоном III объясняется тем, что при образовании комплекса возможно образование пяти пятичленных циклов (4 цикла через карбоновые группы и 1 цикл через атомы азота). Комплексон III широко используется в аналитической химии и технологии. Практически каждый катион металла образует комплекс с комплексоном III в мольном соотношении 1:1.
Комплексы различных металлов характеризуются различным значением констант устойчивости, которые увеличиваются с увеличением заряда катиона, например:
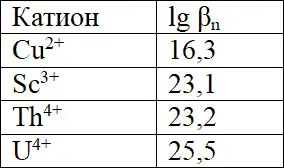
Ионы, образующие более устойчивые соединения могут существовать в более кислой среде.
Возможность образования комплексов в присутствии различных лигандов определяется соотношением констант устойчивости соответствующих комплексных соединений. В зависимости от скорости обмена лигандами, а иногда и центральными ионами, различают инертные и лабильные комплексы. Лабильность комплексов отнюдь не означает, что эти комплексы не устойчивы, т. к. лабильность – понятие кинетическое, а устойчивость – понятие термодинамическое.
Читать дальше

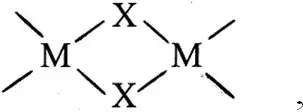

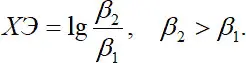 (1.15)
(1.15)