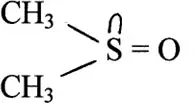Жесткие основаниявследствие прочной и устойчивой электронной оболочки, а также соответствующего строения электронных орбиталей не имеют склонности к образованию ковалентных связей с катионом (F -, O 2-). Рассматривая реакционную способность воды, как донора пары электронов. Можно отметить, что, например, при гидратации катионов, кислород молекулы вода как раз и является жестким центром. Анионы кислородсодержащих кислот, таких как ClO 4 -, SO 4 2-, PO 4 3-, CO 3 2-также имеют малодеформируемую структуру.
В противоположность, мягкие кислоты– большие катионы с деформируемой электронной оболочкой (например, элементы главных подгрупп Cs +, Tl +) а также катионы переходных металлов, в электронной оболочке которых имеются неподеленные пары электронов. Способность к поляризуемости у них выше. Мягкость соединений увеличивается по мере уменьшения положительного заряда ионов.
Аналогично и мягкие основания(P 3-, S 2-, I -, Br -), способность к поляризуемости у которых высока.
Анализируя константы устойчивости комплексов, можно сделать вывод, что жесткие кислоты образуют наиболее прочные соединения с жесткими основаниями, а мягкие кислоты – с мягкими основаниями. Большое значение имеет и то, каким образом формируется соответствующее соединение, что определяет молекулярный контакт при образовании этого соединения:

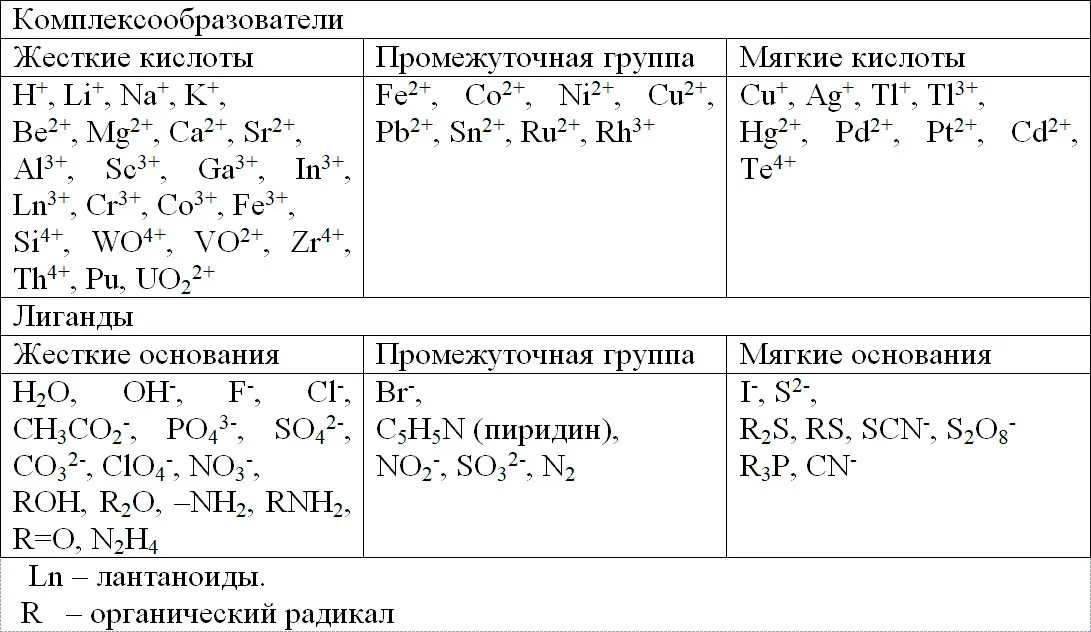
Таким образом, можно провести классификацию комплексообразователей и лигандов (табл.1.2).
Таблица 1.2.
Распределение кислот и оснований по Пирсону.
Актиноиды – типичные жесткие кислоты, для них выполняется следующая зависимость: М 4+> M 3+> MO 2 2+> МO 2 +. Жесткие кислоты, взаимодействуя с жесткими основаниями, образуют соединения, прочность которых подчиняется величине ионного потенциала.
Приведенное высказывание, что жесткие кислоты предпочтительно ассоциируются с жесткими основаниями, а мягкие кислоты – с мягкими основаниями, не означает, что не могут быть получены соединения жесткой кислоты с мягким основанием и наоборот. Например, CH 3 -является мягким основанием, однако легко можно получить соединение типа Mg(CH 3) 2. Тем не менее это соединение термодинамически неустойчиво в отношении гидролиза, тогда как Hg(CH 3) 2устойчиво к гидролизу. Теория жестких и мягких кислот и оснований оказалась полезной для предсказания наиболее стабильных продуктов реакций, для которых не имеется достаточно точных термодинамических характеристик.
Некоторые молекулы имеют как жесткие, так и мягкие центры. В диметилсульфоксиде
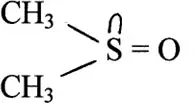
атом кислорода придает жесткие свойства всему соединению, а атом серы – мягкие свойства. Поэтому жесткие кислоты прочно связываются с атомом O, мягкие кислоты – с атомом S. Подобные свойства реализуются для многих органических соединений, которые используются в экстракционных системах.
С помощью теории жестких и мягких кислот и оснований можно предсказать продукты обменной реакции между солями
LiI + AgF ↔ LiF + AgI.
В результате реакции, протекающей в растворе или в твердой фазе, образуются более стабильные соединения между жесткой кислотой и жестким основанием LiF и мягкой кислотой и мягким основанием AgI.
Становится понятным, почему происходит стабилизация металлов с высокой степенью окисления (Th 4+, UO 2 2+) жесткими основаниями (F -, OH -, O 2-) и наоборот.
Таким образом, все ионы металлов стремятся к образованию координационных соединений, вероятно так же и то, что все молекулы и ионы, имеющие по крайней мере одну свободную пару электронов, стремятся к взаимодействию с ионами металлов с образованием комплексов.
В зависимости от способности к комплексообразованию ионы металлов можно разделить на три группы.
1. Ионы металлов с электронной структурой инертного газа, т. е. щелочные, щелочно-земельные, лантаноиды и актиноиды. Все они образуют комплексы со связями электростатического характера. Ионы этих металлов взаимодействуют с анионами небольшого размера, в особенности F -и с лигандами, содержащими в качестве донорных атомов атомы кислорода. Имеют тенденцию образовывать в водных растворах акво-комплексы и не образуют комплексы с аммиаком, сульфидами и не осаждаются ими. Т. к. связи этих металлов носят прежде всего ионный характер, то устойчивость комплексов тем выше, чем больше электронная плотность на ионе металла (ионный потенциал).
Читать дальше