Как правило, применению этих методов предшествуют химические процедуры, носящие подготовительный характер. Химик старается удалить из раствора все те примеси, которые мешают открытию интересующего его катиона, а когда эта работа завершена, то применяет реактив, дающий специфическое окрашивание или осадок с искомым катионом. Осадок, конечно, можно отделить, высушить и взвесить — это будет чисто химический прием. Но окрашенный раствор и даже муть в растворе с осадком можно исследовать оптическими приборами. Результат будет получен гораздо быстрее и часто с большей степенью точности.
С биологическими материалами работать трудно. Биологические объекты содержат белки, жиры, углеводы в сложных сочетаниях, и среди них в относительно малых количествах скрыты искомые ионы. Очевидно, надо избавиться от мешающих веществ. Проще всего это достигается прокаливанием органического материала, в процессе которого обугливаются белки, жиры и углеводы, а в конечном счете выгорает и уголь. Остаток можно растворить например в азотной кислоте и получить кислый раствор солей металлов (избыток кислоты легко нейтрализовать раствором аммиака). Теперь перед нами менее сложная задача — надо проанализировать неорганические вещества — соли. Качественные испытания, как правило, предшествуют количественным измерениям! Существует множество реакций, с помощью которых можно обнаружить присутствие в растворе того или иного катиона. Чаще всего пользуются реакциями образования окрашенных соединений, специфических для данного металла. Так ионы железа (III) с роданидом аммония (или калия) образуют роданид железа кроваво-красного цвета, с гексацианоферратом (II) калия-берлинскую лазурь.
Современная аналитическая химия широко использует комплексные соединения ионов металлов с различными органическими веществами. Подбирая подходящие лиганды и условия реакции, можно быстро обнаружить искомый ион даже в присутствии других ионов металлов. В таблице 7 приведены данные о характерных реакциях некоторых катионов, образующих окрашенные комплексы.
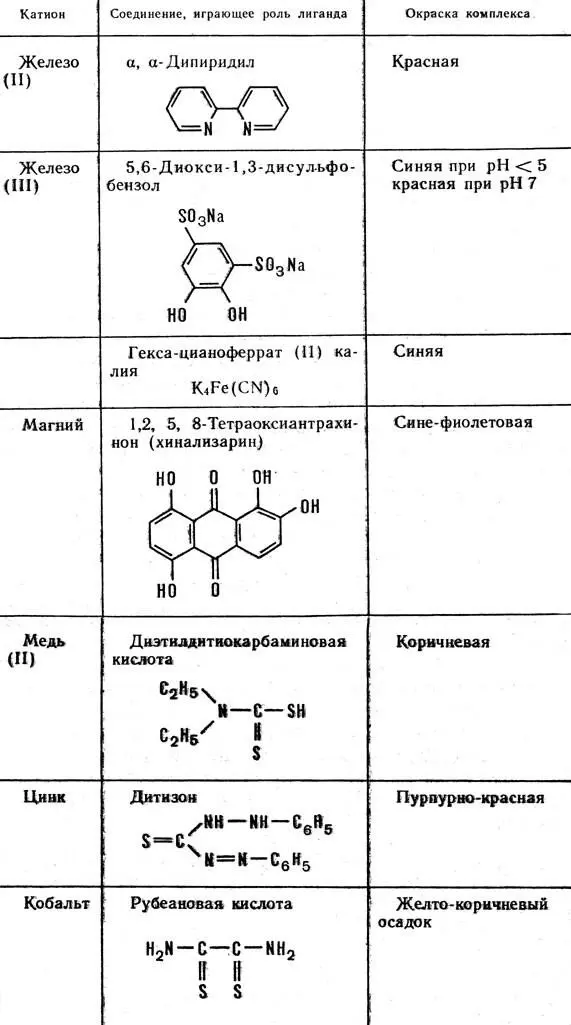
Таблица 7. Образование окрашенных комплексов, применяемых при аналитических определениях металлов
Количественные определения; следующие за качественными, часто основываются на использовании свойств указанных комплексных соединений. Дело в том" что яркая окраска комплексов, способность их интенсивно поглощать свет определенных длин волн открывает возможность измерения количества комплексного соединения фотометрическими методами.
Принцип, лежащий в основе фотометрирования, очень прост. Допустим, что ион металла переведен в комплексное соединение с какими-либо лигандами и полученное соединение ярко окрашено. Нам известно, из какого количества биологического материала получен данный объем раствора (обычно расчет ведут на 100 г материала, например на 100 г мышечной ткани), но неизвестна концентрация комплекса во всем объеме раствора.
Приготовим отдельно в чистом виде точно такой же комплекс и растворим отмеренное (известное) его количество в определенном (известном) объеме воды. Сравним окраски полученного раствора (стандарта) и исследуемого раствора. Если они одинаковы, значит и концентрации окрашенного комплекса в растворах одинаковы. А если разные, то можно приготовить такой стандартный раствор, у которого окраска будет совпадать по интенсивности с окраской исследуемого. Допустим, что исходный стандарт пришлось разбавить вдвое. Значит ли это, что исследуемый раствор имеет концентрацию вдвое меньшую, чем исходный стандарт? Да, безусловно! Но ведь можно и еще проще поступить — сравнить поглощение света в тонких слоях стандарта и данного раствора. Предположим, что стандарт поглощает больше светового излучения, чем данный раствор. Это значит, что концентрация вещества в стандарте больше. В результате тщательных исследований было доказано (закон Бугера-Ламберта-Бера), что между интенсивностью потока света I о, падающего перпендикулярно слою раствора толщиной I, интенсивностью потока света l, прошедшего через слой раствора, и концентрацией раствора с существует математическая зависимость:
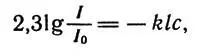
Между интенсивностью потока света I о, падающего перпендикулярно слою раствора толщиной I, интенсивностью потока света l, прошедшего через слой раствора, и концентрацией раствора с существует математическая зависимость
Читать дальше