Вот теперь мы подошли к тому вопросу, о котором и будет речь в этой книге. Пригодны ли те органические соединения, о которых уже многое известно биологам и биохимикам, а именно белки, липиды (жиры), углеводы, — для строительства всех биологических машин, их регулирования и обеспечения их устойчивости в течение длительных сроков жизни организма?
Внимательный анализ этой проблемы и изучение опытных данных о составе живых систем приводят нас к выводу, что необходимое сочетание прочности основных биологических структур и высокой химической активности, характерной для реакции в клетках, не может быть достигнуто, если для создания биологических машин пользоваться только органическими веществами.
Необходимым компонентом живых систем должны быть ионы металлов.
Ознакомимся со свойствами некоторых биологически активных органических соединений и теми функциями, которые способны выполнять ионы металлов.
Из курса химии известно, как построены белки, жиры и углеводы. Их молекулы содержат цепи атомов. У белков атомы углерода соединены перемычками, состоящими из групп NH-СО. Перемычки возникают потому, что огромная молекула белка получается в результате соединения (конденсации) аминокислот. В простейшем случае аминокислота глицин NH 2-СН 2-COOH может образовать дипептид — продукт конденсации двух молекул глицина по реакции:
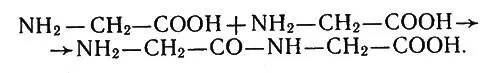
Дипептид — продукт конденсации двух молекул глицина
Таким путем, очевидно, можно соединять друг с другом и молекулы других аминокислот; всего в живых организмах насчитывается 20 аминокислот различного строения.
Каждая молекула белка состоит из нескольких сотен аминокислотных остатков — химики называют такую частицу полипептидом ("многопептидом").
Молекулы жиров содержат цепи атомов углерода и эфирные группы -СОО-, связывающие цепи жирных кислот и глицерина:
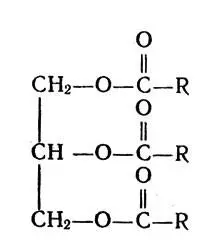
Молекулы жиров содержат цепи атомов углерода и эфирные группы -СОО-
( 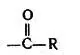 — остаток жирной кислоты, например пальмитиновой С 15Н 31СООН).
— остаток жирной кислоты, например пальмитиновой С 15Н 31СООН).
Для молекул углеводов также характерно наличие цепей атомов углерода, но эти цепи для углеводов, относящихся к полисахаридам (крахмал, гликоген), содержат перемычки из атомов кислорода.
Мы только напоминаем об этих данных, так как для нас сейчас важно обратить внимание на распространенность в биологических объектах органических молекул, которые характеризуются наличием ковалентных связей.
Действительно, атомы углерода в цепочках -С-С-С-, имеющихся и в белках, и в жирах, и в углеводах, соединены парами общих электронов; связи между атомом углерода и атомом азота в перемычке (связующем звене) -NH-СО- также ковалентные; ковалентными являются и связи С-О в молекулах углеводов. Их энергия довольно велика.
Легко ли заставить молекулы биологически активных веществ вступать в реакции? Остановимся на одной из наиболее важных и общеизвестных реакций — реакции горения. Ведь мы знаем, что углеводы (например, обычный сахар), белки и жиры "сгорают" в организме, образуя в конечном счете воду и диоксид углерода (углекислый газ). Попробуем окислить сахар или жир до этих продуктов вне организма. Мы обнаружим, что сахар можно хранить годами на воздухе, а значит — в присутствии кислорода, и он не покажет никаких признаков окисления. Жир испортится — прогоркнет, т. е. станет добычей различных микроорганизмов, но тоже, конечно, не сгорит; признаки его окисления мы сможем обнаружить, но до превращения его в воду и диоксид углерода будет очень далеко. Белки подвергнутся высыханию, разрушительному действию микроорганизмов, но не сгорят!
А ведь в клетках организма процессы окисления идут очень быстро. Так, например, утомленный бегун на финише восстанавливает силы буквально за несколько минут, выпив раствор глюкозы.
Почему же организм так легко справляется с задачей ускорения нужных ему реакций? Ответ на этот вопрос не вызывает сомнений у биохимиков: потому, что в клетках имеются мощные катализаторы — ферменты, стимулирующие при невысоких температурах реакции окисления.
Можно попробовать зажечь кусочек сахара — он загорится с трудом лишь при энергичном нагревании в пламени газовой горелки. Но попробуйте нанести на его поверхность немного порошка оксида меди — в этом случае сахар удастся зажечь просто от пламени спички. Иногда этот опыт проделывают, применяя вместо оксида меди табачную золу, — она содержит малые количества оксидов металлов и также проявляет ускоряющее действие. Что же здесь играет роль катализатора? Конечно, металл! Металл в ионном состоянии. Соединения меди, железа, марганца, ванадия, кобальта и других в большом числе реакций действуют как катализаторы окислительно-восстановительных реакций. Нет такого органического соединения, не содержащего металла, которое обладало бы столь сильно выраженными каталитическими свойствами в реакциях окисления.
Читать дальше
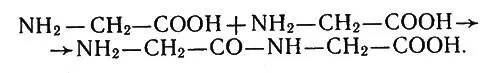

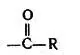 — остаток жирной кислоты, например пальмитиновой С 15Н 31СООН).
— остаток жирной кислоты, например пальмитиновой С 15Н 31СООН).






