Примером тому сухой лед, которым охлаждают мороженое. Это превращенный в твердое кристаллическое тело углекислый газ. Частицы, образующие кристалл сухого льда, — молекулы. Они, так же как и ионы в кристалле поваренной соли, уложены с возможно большей плотностью. Однако молекулы углекислого газа имеют более сложную форму, чем шарики-ионы, и уложить их плотно труднее. Поэтому упаковка кристалла, состоящего из молекул (рис. 50), получается более рыхлой, чем у кристалла, состоящего из ионов или атомов.

Рис. 50. Строение кристалла сухого льда.
Особенно неплотно упакованы молекулы воды в кристалле льда, модель которого изображена на рисунке 51. Для удобства здесь атомы водорода (черные шарики) и кислорода (белые шарики) изображены одинаковыми, хотя в действительности их размеры различны.

Рис. 51. Строение кристалла обычного льда.
Ажурный характер кристалла льда — причина его малой плотности: мы знаем, что лед плавает на поверхности воды.
При таянии льда молекулы укладываются более плотно и объем, занимаемый веществом, уменьшается.
Упорядоченное расположение частиц делает свойства кристаллов не похожими на свойства жидкостей и газов.
Жидкость, например, одинаково сопротивляется растяжению, вне зависимости от того, в каком направлении ее растягивать. Если жидкость разрывается, то никаких определенных плоскостей, по которым преимущественно происходил бы этот разрыв, указать нельзя. Один раз разрыв произойдет так, другой раз иначе.
Совсем по-иному ведут себя кристаллы.
В каждом из них имеются плоскости, по которым разрыв происходит легче, чем по другим. Они называются плоскостями спайности.
Кристалл поваренной соли, какова бы ни была его форма, раскалывается на кусочки, каждый из которых кубик или прямоугольный параллелепипед.
Слюда от самого незначительного усилия расщепляется на отдельные пластинки. При желании можно изготовить тончайшие слюдяные пластинки, более тонкие, чем бумажный листок.
Эти особенности кристаллов объясняются строением их кристаллических решеток.
Взгляните на кристаллическую решетку поваренной соли. На плоскостях, параллельных какой-либо грани куба, располагаются вперемежку ионы натрия и ионы хлора. Ионы натрия, находящиеся в одной плоскости, будут притягиваться ионами хлора, лежащими в соседней плоскости, и одновременно отталкиваться лежащими в этой плоскости одноименными с ними ионами натрия. А так как ионов натрия и ионов хлора в каждой плоскости одинаковое количество, то такие плоскости будут притягиваться одна к другой в общем с небольшой силой. Это и есть плоскости спайности.
Иная картина наблюдается на диагональных плоскостях (рис. 52).
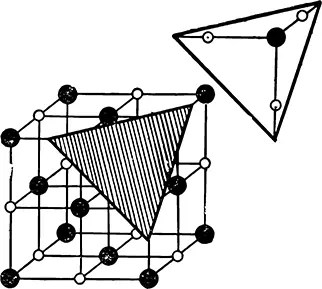
Рис. 52. Диагональные плоскости в кристалле поваренной соли.
Здесь на одной плоскости встречаются только ионы натрия, а на соседних с нею только ионы хлора. Силы сцепления между такими плоскостями велики, и кристалл по диагональным плоскостям не раскалывается.
В слюде, так же как и в графите, частицы, лежащие в одном и том же слое, связаны между собою гораздо крепче, чем расположенные в соседних слоях. Поэтому слюда и расщепляется на тонкие листочки.
В том, что свойства кристаллов различны в различных направлениях, можно убедиться, проделав такой простой опыт.
В природе часто встречаются прозрачные кристаллы горного хрусталя, обычно они образуют красивые сростки — друзы (рис. 53).

Рис. 53. Друзы горного хрусталя.
Горный хрусталь, или кварц, — это соединение кремния с кислородом, или, как говорят химики, двуокись кремния. Кварц — распространенный минерал. На его долю приходится примерно 12 процентов вещества земной коры.
Покроем одну из боковых граней кристалла кварца ровным слоем воска и прикоснемся к ее середине концом раскаленной проволоки. Распространяющееся от проволочки тепло заставит воск расплавиться, образуется лунка в форме эллипса (рис. 54).
Читать дальше
![Борис Кудрявцев Первоначала вещей [Очерк о строении вещества] обложка книги](/books/395090/boris-kudryavcev-pervonachala-vechej-ocherk-o-stroeni-cover.webp)















