1.4. Непохожие друг на друга
Чем же отличаются органические вещества от неорганических?
Чтобы ответить на этот вопрос, проделаем очень простой опыт. Нагреем несколько кристаллов органического вещества. Даже при сравнительно невысокой температуре они начинают плавиться и переходят в жидкое состояние. Если температуру еще повысить, то эта жидкость начинает пениться (кипеть), а потом разлагаться, сгорать или обугливаться. Например, если сухую деревянную палочку внести в огонь, то она, постепенно обугливаясь, сгорает и переходит в тлеющие угли. Проделаем еще такой опыт. Возьмем пинцетом кусочек сахара и внесем его в пламя горелки. Вначале из сахара выделяются газы, затем он обугливается и сгорает.
Если охладить продукты, которые получились от сгорания палочки и сахара, то в них вы не узнаете прежние предметы.
А теперь поступим иначе. Внесем в пламя любое неорганическое вещество, например хлорид натрия. Вы увидите, что соль ведет себя совсем иначе, чем палочка и кусочек сахара. Соль выдерживает даже очень высокую температуру. Она вначале растрескивается на мелкие кусочки, а потом, если бы удалось повысить температуру до 800 °С, начинает плавиться. При 1440 °С расплавленная соль закипает. Но стоит расплавленную соль охладить, как получается тот же продукт, что был вначале. Эта соль опять пригодна для приготовления пищи!
Есть еще одно отличие между органическими и неорганическими веществами. Известно, что большинство неорганических веществ хорошо растворимо в воде. В то же время органических веществ, которые растворяются в воде, не так уж и много. Почему?
Чтобы ответить на этот вопрос, необходимо рассмотреть, как связаны между собой атомы в молекулах неорганических и органических веществ.
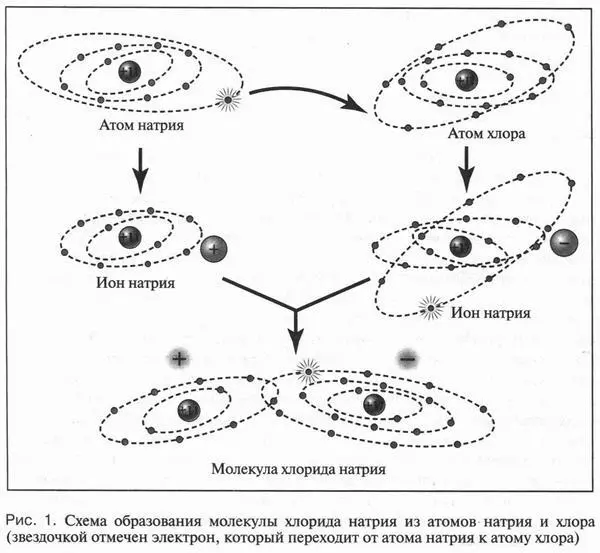
Известно, что любой атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и отрицательно заряженных электронов, окружающих это ядро. Электроны располагаются от ядра на различных расстояниях. Группы электронов, удаленные на одинаковое расстояние от ядра и обладающие одинаковой энергией, образуют слои (оболочки). Чем дальше от ядра расположены эти слои, тем большей энергией обладают их электроны. Поскольку атом — нейтральная частица, то это означает полную компенсацию положительного заряда ядра отрицательным зарядом всех электронов, входящих в атом. Но иногда такой компенсации не происходит. Это связано с тем, что число электронов в атоме может изменяться: при определенных условиях атом способен присоединять или отдавать несколько электронов. Если атом принимает электроны, то возникает избыточный отрицательный заряд и нейтральный атом превращается в отрицательную частицу — анион. Если же атом отдает электроны, то преобладает положительный заряд ядра и образуется положительно заряженный ион — катион. Поясним это на примере образования молекулы хлорида натрия. Атом натрия при взаимодействии с атомом хлора отдает ему единственный электрон, который расположен на внешнем электронном слое. В результате у атома натрия остаются 10 электронов (всего же было 11 электронов), а у атома хлора их будет уже 18 (было 17) (рис. 1). Так как терять и приобретать электроны могут только внешние электронные слои атомов, то на этих слоях у атомов натрия и хлора остается по восемь электронов, как у инертных газов (неона, аргона и др.). Следовательно, эти слои приобретают устойчивую электронную конфигурацию. Итак, вместо нейтрального атома натрия образовался катион, а атом хлора превратился в противоположную частицу — анион. Поскольку разноименные заряды, как известно, притягиваются, то из ионов образуется молекула хлорида натрия. Связь между катионом и анионом хлора называется ионной. Молекулы, имеющие ионную связь, всегда полярны, так как в них в одной области группируются положительные заряды, а в другой — отрицательные. Теперь посмотрим, что же происходит при растворении полярной молекулы хлорида натрия в воде.
Сразу же напомним, что в молекуле воды также преобладает ионная связь. Когда же полярные молекулы воды приближаются к полярным молекулам хлорида натрия, то происходит ориентация этих молекул друг относительно друга. Они располагаются так, что к катиону натрия и аниону хлора подходят молекулы воды с противоположным знаком. В результате между молекулами воды и хлорида натрия возникает притяжение. Затем молекулы воды внедряются между ионами хлорида натрия, ослабляют связь между ними и «растаскивают» ионы натрия и хлора в разные стороны. Вот так происходит процесс растворения неорганических веществ.
Читать дальше












