Азотный ангидрид (пятиокись азота) N 2O 5— бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N 2O 5+Н 2O = 2HNO 3, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 2HNO 3+ P 2O 5= N 2O 5+ 2HPO 3. Практического применения не находит. Все А. о. физиологически активны.
Лит. см. при ст. Азот , Азотная кислота .
Азоти'рование,насыщение поверхности металлических деталей азотом с целью повышения твёрдости, износоустойчивости, предела усталости и коррозионной стойкости. А. подвергают сталь, титан, некоторые сплавы, наиболее часто — легированные стали, особенно хромоалюминиевые, а также сталь, содержащую ванадий и молибден.
Азотирование стали происходит при t 500—650 °С в среде аммиака. Выше 400 °С начинается диссоциация аммиака по реакции NH 3® 3H + N. Образовавшийся атомарный азот диффундирует в металл, образуя азотистые фазы. При температуре А. ниже 591 °С азотированный слой состоит из трёх фаз (рис.): e — нитрида Fe 2N, g' — нитрида Fe 4N, a — азотистого феррита, содержащего около 0,01% азота при комнатной температуре. При температуре А. 600—650° С возможно образование ещё и g-фазы, которая в результате медленного охлаждения распадается при 591°C на эвтектоид a + g 1. Твёрдость азотированного слоя увеличивается до HV = 1200 (соответствует 12 Гн/м 2 ) и сохраняется при повторных нагревах до 500—600°C, что обеспечивает высокую износоустойчивость деталей при повышенных температурах. Азотированные стали значительно превосходят по износоустойчивости цементированные и закалённые стали. А. — длительный процесс, для получения слоя толщиной 0,2—0,4 мм требуется 20—50 ч. Повышение температуры ускоряет процесс, но снижает твёрдость слоя. Для защиты мест, не подлежащих А., применяются лужение (для конструкционных сталей) и никелирование (для нержавеющих и жаропрочных сталей). Для уменьшения хрупкости слоя А. жаропрочных сталей иногда ведут в смеси аммиака и азота.
Азотирование титановых сплавов проводится при 850—950 °С в азоте высокой чистоты (А. в аммиаке не применяется из-за увеличения хрупкости металла).
При А. образуется верхний тонкий нитридный слой и твёрдый раствор азота в a-титане. Глубина слоя за 30 ч — 0,08 мм с поверхностной твёрдостью HV = 800—850 (соответствует 8—8,5 Гн/м 2 ) . Введение в сплав некоторых легирующих элементов (Al до 3%, Zr 3—5% и др.) повышает скорость диффузии азота, увеличивая глубину азотированного слоя, а хром уменьшает скорость диффузии. А. титановых сплавов в разреженном азоте [100—10 н/м 2 (1—0,1 мм рт ст. )] позволяет получать более глубокий слой без хрупкой нитридной зоны.
А. широко применяют в промышленности, в том числе для деталей, работающих при t до 500—600 °С (гильз цилиндров, коленчатых валов, шестерён, золотниковых пар, деталей топливной аппаратуры и др.).
Лит.: Минкевич А. Н., Химико-термическая обработка металлов и сплавов, 2 изд., М., 1965: Гуляев А. П..Металловедение, 4 изд., М., 1966.
Д. И. Браславский .
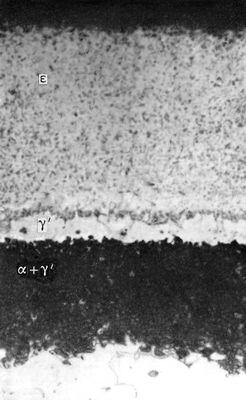
Макроструктура азотированного слоя железа при 650°C (увеличено в 500 раз).
Азо'тистая кислота',HNO 2, одноосновная, нестойкая, довольно слабая кислота, существующая только в разбавленных холодных водных растворах. Структурная формула HO—N = О. Константа диссоциации А. к. 4,5×10 -4при 18°C. Образуется наряду с азотной кислотой при растворении NO 2в воде: 2NO 2+ H 2O = HNO 2+ HNO 3. При нагревании и действии сильных кислот или окислителей А. к. разлагается с образованием окиси азота: 3HNO 2= HNO 3+ 2NO + H 2O. Восстановлением А. к. могут быть получены N 2O,NO, NH 2OH, NH 3и др. Соли А. к. ( нитриты ) получают восстановлением нитратов . Наиболее важное свойство А. к .— способность к диазотированию ароматических аминов. Поэтому в производстве азокрасителей широко применяют натрия нитрит NaNO 2; при действии на эту соль кислот образуется свободная А. к.:
NaNO 2+HCI = NaCI+HNO 2.
А. к. и её соли при попадании внутрь ядовиты. Профессиональные отравления редки. Нитрит натрия применяют в медицине при стенокардии и спазмах сосудов головного мозга (см. Сосудорасширяющие средства ).
Азотистоводородная кислота
Азотистоводоро'дная кислота',азоимид, HN 3, соединение азота с водородом, бесцветная летучая жидкость с резким запахом. Структурная формула Н—N = N º N. Плотность 1130 кг/м 3, t кип37° С, t пл—80° С. Безводная А. к. при нагревании или при сотрясении сосуда взрывается, разлагаясь на азот и водород; в разбавленных водных растворах устойчива. В водных растворах А. к. диссоциирует на ионы Н +и N -3, причём по силе она близка к уксусной. Помимо кислотной функции, для А. к. характерна и окислительная: смесь А. к. с крепкой соляной кислотой растворяет золото и платину, т. е. ведёт себя аналогично царской водке . А. к. получают действием на её соли разбавленной серной кислоты. Практическое применение имеют только соли А. к. — азиды .
Читать дальше












