А. Б. Фрадков.
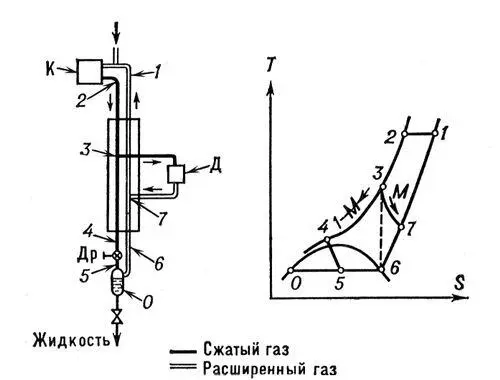
Рис. 3. Схема и диаграмма Т — S (температура — энтропия) цикла сжижения газов с детандером: К — компрессор; Д — детандер; Др — дроссельный вентиль.
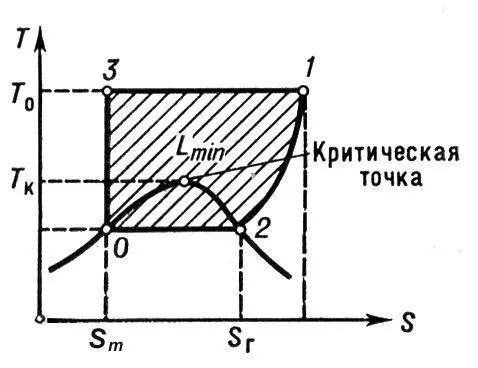
Рис. 1. Идеальный цикл сжижения газов на диаграмме T—S (температура — энтропия).
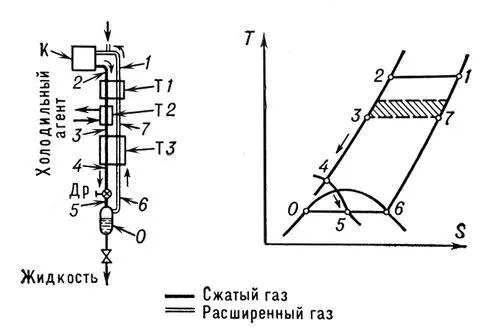
Рис. 2. Схема и диаграмма Т — S (температура — энтропия) цикла сжижения газов на основе эффекта Джоуля — Томсона: К — компрессор; T1, T2, ТЗ — теплообменники; Др — дроссельный вентиль.
Сжима'емость,способность вещества изменять свой объём под действием всестороннего давления. С. обладают все вещества. Если вещество в процессе сжатия не испытывает химических, структурных и других изменений, то при возвращении внешнего давления к исходному значению начальный объём восстанавливается. У твёрдых тел, имеющих поры, трещины и другие неоднородности структуры, практически обратимая С. может наблюдаться только при достаточно высоком давлении (например, у горных пород при давлении большем 2—5 кбар ; 1 кбар = 10 8 н/м 2 ).
Обычно С. (объёмной упругостью) называется обратимое изменение занимаемого веществом объёма V под равномерным гидростатическим давлением р . Величину С. характеризует коэффициент С. (b, который выражает уменьшение единичного объёма тела при увеличении р на одну единицу: 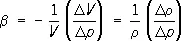 , где D V и Dr — изменения объёма V и плотности r при изменении р на величину D р . К = 1/b называют модулем объёмной упругости (модулем объёмного сжатия, объёмным модулем), для твердых тел
, где D V и Dr — изменения объёма V и плотности r при изменении р на величину D р . К = 1/b называют модулем объёмной упругости (модулем объёмного сжатия, объёмным модулем), для твердых тел 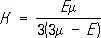 , где Е — модуль нормальной упругости ( Юнга модуль ), m — модуль сдвига. Для идеальных газов К = р при любой температуре Т . В общем случае С. вещества, а следовательно К и b, зависит от р и Т . Как правило, b убывает при увеличении р и растет с Т . Часто С. характеризуют относит. плотностью d = r/r 0, где r 0— плотность при О °С и р = 1 атм .
, где Е — модуль нормальной упругости ( Юнга модуль ), m — модуль сдвига. Для идеальных газов К = р при любой температуре Т . В общем случае С. вещества, а следовательно К и b, зависит от р и Т . Как правило, b убывает при увеличении р и растет с Т . Часто С. характеризуют относит. плотностью d = r/r 0, где r 0— плотность при О °С и р = 1 атм .
Сжатие может происходить как при постоянной температуре (изотермически), так и с одновременным разогревом сжимаемого тела (например, в адиабатном процессе). В последнем случае значения К будут большими, чем при изотермическом сжатии (для большинства твёрдых тел при обычной температуре — на несколько %).
Для оценки С. веществ в широком диапазоне давлений используют уравнения состояния, выражающие связь между р , V и Т . Определяют С. непосредственно по изменению объёма тел под давлением (см. Пьезометр ), из акустических измерений скорости распространения упругих волн в веществе, из экспериментов по ударному сжатию, дающих зависимость между r и р при максимальных полученных в эксперименте давлениях. С. находят также из измерений параметров кристаллической решётки под давлением, производимых методом рентгеновского структурного анализа . С. можно определить с помощью измерения линейной деформации твёрдого тела под гидростатическим давлением (по т. н. линейной С.). Для изотропного тела коэффициент линейной С. 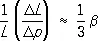 , где L — линейный размер тела.
, где L — линейный размер тела.
С. газов, будучи очень большой при давлениях до 1 кбар , по мере приближения их плотности к плотности жидкостей становится близкой к С. жидкостей. Последняя с ростом р уменьшается сначала резко, а затем меняется весьма мало: в интервале 6—12 кбар b уменьшается примерно так же, как в интервале от 1 атм (10 -3 кбар ) до 1 кбар (примерно в 2 раза), и при 10—12 кбар составляет 5—10% от начального значения. При 30—50 кбар модули К жидкостей по порядку величины близки к К твёрдых тел. Для твёрдых тел при 100 кбар Dr/r 0» 15—25%. Для отдельных веществ, например щелочных металлов, Dr/r ~ 40%, для большинства др. металлов ~ 6—15%. Линейная С. анизотропных веществ зависит от кристаллографических направлений (во всяком случае, до давлений в десятки кбар ), причём вдоль направлений со слабым межатомным взаимодействием она может в 8—10 раз превосходить С. по направлениям, вдоль которых в кристаллической решётке имеет место более сильная связь; изменение параметра решётки в этих направлениях в определённом интервале р может быть даже положительным (теллур, селен). С. — важнейшая характеристика вещества, которая позволяет судить о зависимости физических свойств от межатомных (межмолекулярных) расстояний.
Читать дальше




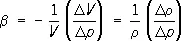 , где D V и Dr — изменения объёма V и плотности r при изменении р на величину D р . К = 1/b называют модулем объёмной упругости (модулем объёмного сжатия, объёмным модулем), для твердых тел
, где D V и Dr — изменения объёма V и плотности r при изменении р на величину D р . К = 1/b называют модулем объёмной упругости (модулем объёмного сжатия, объёмным модулем), для твердых тел 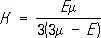 , где Е — модуль нормальной упругости ( Юнга модуль ), m — модуль сдвига. Для идеальных газов К = р при любой температуре Т . В общем случае С. вещества, а следовательно К и b, зависит от р и Т . Как правило, b убывает при увеличении р и растет с Т . Часто С. характеризуют относит. плотностью d = r/r 0, где r 0— плотность при О °С и р = 1 атм .
, где Е — модуль нормальной упругости ( Юнга модуль ), m — модуль сдвига. Для идеальных газов К = р при любой температуре Т . В общем случае С. вещества, а следовательно К и b, зависит от р и Т . Как правило, b убывает при увеличении р и растет с Т . Часто С. характеризуют относит. плотностью d = r/r 0, где r 0— плотность при О °С и р = 1 атм .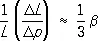 , где L — линейный размер тела.
, где L — линейный размер тела.