Las escalas relativas tienen temperaturas negativas y las absolutas no, y la temperatura absoluta es igual a la temperatura relativa más la temperatura absoluta del cero elegido en la escala de la temperatura relativa. Por ejemplo, ºK = °C + 273,15, ya que 0 ºC son 273,15 ºK.
En el S.I. se utiliza como escala absoluta el grado Kelvin y como escala relativa el grado Celsius:
1 En la escala de grado Celsius (°C), la escala es de cien unidades entre la temperatura de fusión y ebullición del agua, es decir, entre 0 °C y 100 °C respectivamente.
2 En la escala Kelvin (°K) el cero absoluto corresponde a -273,15 °C.
En el S.A. se tiene como escala absoluta el grado Rankine y como escala relativa el grado Fahrenheit:
1 En la escala Fahrenheit (°F), la escala es de cien unidades entre la temperatura de congelación de una disolución de cloruro amónico y la temperatura normal corporal humana. Estos puntos corresponden a 0 °F y 100 °F respectivamente.
2 En la escala Rankine (ºR) el cero absoluto corresponde a -459,67 ºF.
La relación entre las distintas unidades respecto a los grados Celsius es:
| ºC = ºK – 273,15 |
ºK = °C + 273,15 |
| ºC = (°F - 32) · 5/9 |
ºF = ºC · 9/5 + 32 |
| ºC = (ºR - 491,67) · 5/9 |
ºR = (ºC + 273,15) · 9/5 |
2.4. Transferencia de calor. Principios. Aplicaciones en la planta química
En multitud de operaciones en las plantas químicas se producen emisiones o absorciones de energía en forma de calor. Por ello, el estudio de la transferencia de calor y de sus aplicaciones tiene tanta importancia para esta actividad.
El calor como forma de transmisión de la energía
Se sabe que si se ponen en contacto dos objetos que tienen diferente temperatura se produce un flujo o transferencia de energía desde el más caliente al más frío hasta que ambos objetos alcancen la misma temperatura.
Esta energía transferida, debido a una diferencia de temperaturas de un cuerpo a otro se hace en forma de calor y se denomina transmisión o transferencia de calor.
Esto se debe a que la diferencia de temperaturas actúa como fuerza impulsora de la energía de un objeto de mayor temperatura a uno de menor.

Nota
Sin embargo, si se ponen en contacto dos objetos con la misma temperatura no habrá transferencia de energía porque la energía media de las partículas en cada objeto es la misma, y, por tanto, no hay fuerza impulsora.
Siempre que exista una diferencia de temperaturas en un cuerpo o entre cuerpos se dará una transferencia de calor y el cuerpo más caliente reducirá su temperatura y el más frío la aumentará hasta que ambos tengan la misma temperatura y se encuentren en lo que se denomina equilibrio térmico.
Además, a mayor gradiente de temperaturas o diferencia de temperaturas, mayor será la velocidad de transferencia de calor.
Estados de la materia (cambios de estado)
La materia se presenta en la naturaleza en forma de tres fases o estados diferentes según sea la energía intermolecular o el calor que posea: sólido, líquido y gaseoso. Hay un cuarto estado que es el plasma, pero tiene poca incidencia para esta actividad.
En el estado sólidolas fuerzas de atracción intermolecular o de cohesión son muy fuertes, y mantiene su volumen y su forma definida. Sus partículas se ordenan en redes cristalinas y están dotadas de movimiento de vibración. Ejemplo: el hielo.

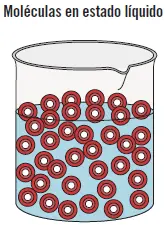
En el estado líquidolas fuerzas de atracción intermolecular no son tan grandes y mantienen su volumen, pero adoptan la forma del recipiente que lo contiene mostrando una superficie libre. Sus partículas tienen libertad de movimiento pero están muy juntas. Ejemplo: el agua.
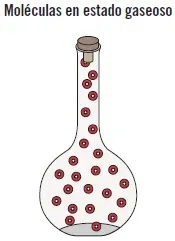
En el estado gaseosolas fuerzas de cohesión son tan débiles que el gas no tiene ni forma ni volumen propio, adoptan la forma del recipiente que los contiene y ocupan todo su volumen. Sus partículas tienen libertad de movimiento y están muy separadas debido a la fuerza de cohesión tan débil. Ejemplo: el vapor de agua.

Sabía que...
Se denominan vapores a aquellos gases que en condiciones normales de presión y temperatura, es decir, 1 atm y temperatura ambiente respectivamente, tienen como estado normal el estado líquido. Por ejemplo, el vapor de agua.
Si a un cuerpo en estado sólido se le aporta calor, aumentará su energía interna, logrando que sus moléculas puedan vencer determinadas fuerzas de cohesión, obteniéndose el estado líquido. Si se continúa aportando calor se llega a un punto en que la energía molecular es superior a las fuerzas de cohesión, rompiéndose totalmente estas y alcanzándose el estado gaseoso de la materia.
Por tanto, aportando calor a un cuerpo, este puede pasar de sólido a líquido y a gas, y de forma inversa, al enfriarlo se recorrerá el camino en sentido contrario. Estos son los cambios de estado más usuales, aunque se puede cambiar de estado de sólido a gas y de gas a sólido, aportando calor y enfriando respectivamente.

Importante
Se debe tener en cuenta que en estos cambios de fase no se producen transformaciones de estas sustancias en otras, son las mismas sustancias pero en otro estado.
Las diferentes transformaciones o cambios de fase en la materia son los que aparecen en la siguiente tabla.
| Fusión |
Proceso físico por el que una sustancia en estado sólido pasa a estado líquido mediante aporte de calor. La temperatura a la que el sólido se funde se denomina punto de fusión y es un valor particular para cada sustancia. |
| Solidificación |
Proceso físico por el que una sustancia en estado líquido pasa a estado sólido mediante un enfriamiento. |
| Vaporización |
Proceso físico por el que una sustancia en estado líquido pasa a estado gaseoso. La temperatura a la que el líquido se vaporiza se denomina punto de ebullición y es un valor particular para cada sustancia y depende de la presión a la que se encuentre esta. |
| Condensación |
Proceso físico por el que una sustancia en estado gaseoso pasa a estado líquido. |
| Sublimación |
Proceso físico por el que una sustancia en estado sólido pasa a estado gaseoso sin pasar por el estado líquido. |
| Cristalización |
Proceso físico por el que una sustancia en estado gaseoso pasa a estado sólido, sin pasar por el estado líquido. |

Nota
Son procesos exotérmicos aquellos que desprenden energía o calor como la condensación, la solidificación o la cristalización. Son procesos endotérmicos aquellos que necesitan energía o calor para producirse como la fusión, la vaporización o la sublimación.
Читать дальше


















