1 ...8 9 10 12 13 14 ...35 Введение новой характеристики вещества – «Плотность атома»
Гипотеза 10
Атомы оцениваются по ряду характеристик: атомной массе, энергии ионизации, атомному радиусу, периоду полураспада…, в этой гипотезе предложено оценивать атомы ещё по одной характеристике. Введено понятие ПЛОТНОСТЬ АТОМА и рассчитаны плотности атомов для всех элементов [Тимофеев, 2009б].
Плотность атома равна атомному весу, деленному на объем атома.
Атомные веса элементов известны и имеются в справочниках. Атомные объемы нетрудно рассчитать, принимая, что атомы имеют форму шара, а атомные радиусы известны.
Значение атомных радиусов не однозначное, а зависит от вида связи между атомами. Радиусы бывают ковалентные, ионные, металлические ван-дер-ваальсовы. [ Волков,Жарский. 2005]. Кроме, того, ковалентные связи могут быть как одинарные, так и двойные или тройные и размеры этих связей разные. Имеет значение и структура кристаллической решетки. В некоторых книгах, например, [Неницеску 1968], на это не обращалось особого внимания. Получилось так, что в первом издании книги взятые из этих источников величины атомных радиусов для атомов инертных газов соответствовали ван-дер-ваальсовым радиусам. Однако ван-дер-ваальсовы радиусы создаются незначительными силами и не могут сохраняться в условиях высоких давлений глубин Земли. Более правильно, в случае рассмотрения вопросов геологии, для инертных газов использовать ковалентные радиусы, что сделано в этом издании. Это привело здесь к значительному увеличению расчётных значений плотностей их атомов. В расчётах плотностей атомов для всех элементов использованы значения одинарных ковалентных радиусов, образующих прочные связи между атомами и имеющие широкое распространение в том числе и для органических веществ, а также использованы значения металлических радиусов.
Атомные радиусы взяты из справочника Волков, А.И., Жарский, И. М. Большой химический справочник / А. И. Волков, И. М. Жарский. – Мн.: Современная школа, 2005. – 608 с ISBN 985-6751-04-7. https://bookree.org/reader?file=627009&pg=47
Недостающие в справочнике атомные радиусы, отмеченные значком * взяты из «Краткой химической энциклопедии М 1963».
Ковалентные радиусы атомов показаны в (таблице 4).
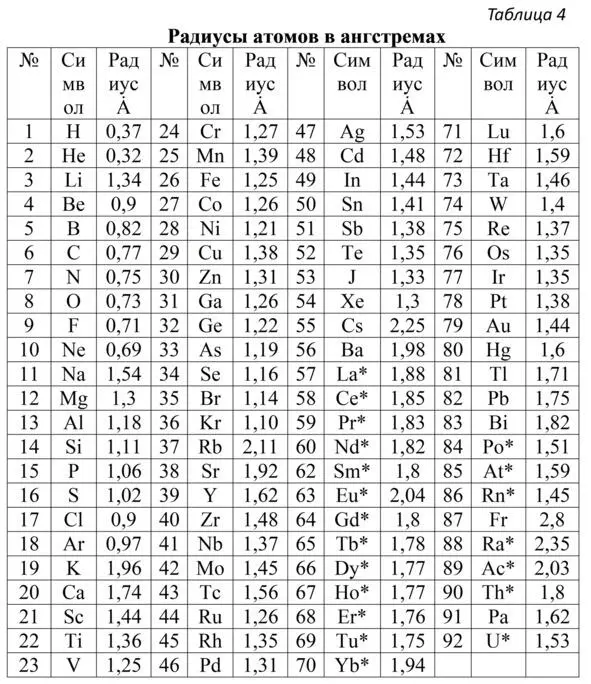
Более наглядно картина изменения радиусов атомов, расположенных в порядке увеличения атомных номеров (как в таблице Д. И. Менделеева) (рис. 7). Элементы, показанные серым цветом, стабильных изотопов не имеют, и в природе встречаются в незначительных количествах.
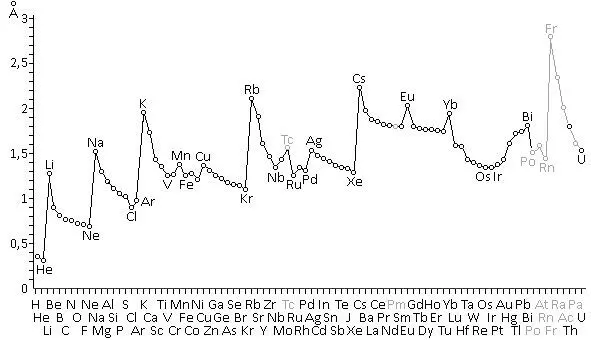
Рис. 7.Изменения радиусов атомов в порядке увеличения атомных номеров элементов.
На рисунке видно, что радиусы атомов не увеличиваются равномерно по мере увеличения их атомных весов, а изменяются с периодичностью, соответствующей периодам элементов в таблице Д. И. Менделеева. При этом в периодах таблицы наибольшими радиусами обладают щелочные металлы, а наименьшими, как правило, инертные газы.
По значениям атомных радиусов рассчитаны объёмы атомов, а далее плотности атомов (впервые опубликованы в работе [Тимофеев, 2009б]). Для более понятного представления, плотности атомов из рассчитанных значений в атомных массах, делённых на кубические ангстремы переведены в привычные единицы г/см 3. Полученные значения плотностей атомов в порядке их возрастания показаны в (таблице 5).
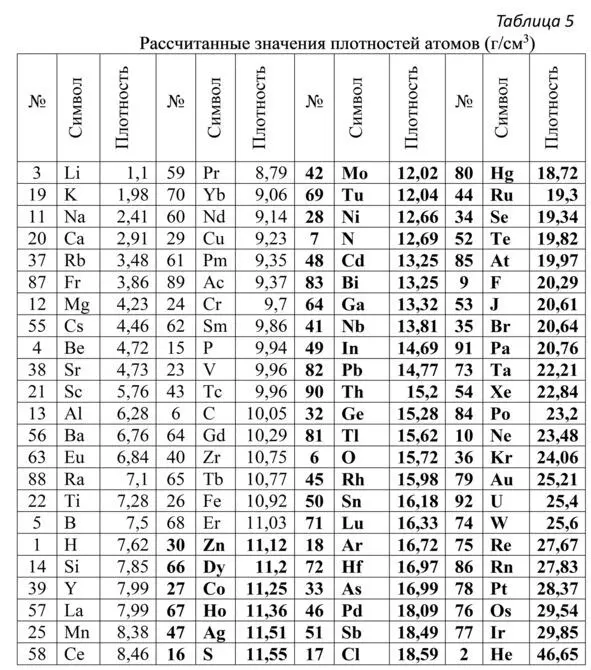
Для наглядности плотностей атомов элементов (рис. 8). Видно, что плотности возрастают не в порядке возрастания атомных номеров элементов.
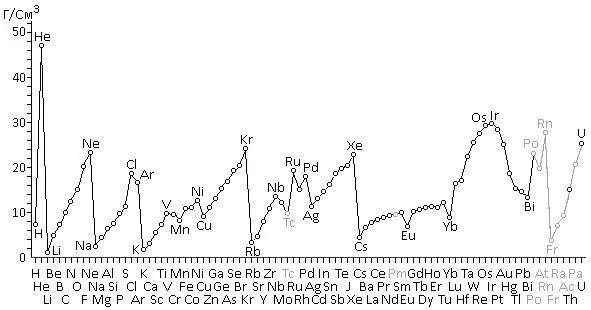
Рис. 8.График изменения плотности атомов в порядке увеличения атомных номеров
Если малая плотность атомов щелочных металлов была предсказуема, то совершенно неожиданным оказалось аномально высокое значение плотности гелия.
Рассчитанные плотности атомов в порядке возрастания значений (рис. 9)
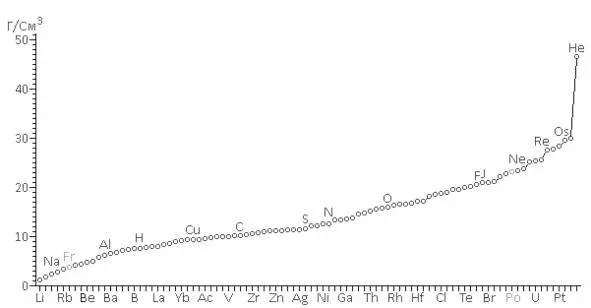
Рис. 9.Кривая изменения плотности атомов в порядке возрастания значений
Читать дальше














