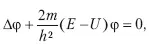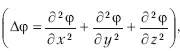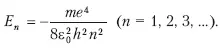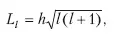m eυ nr n= nh, n = 1, 2, 3, …,
где = 1,05 · 10 -34Дж · с – постоянная Планка (величина h/(2π)) встречается столь часто, что для нее введено специальное обозначение («аш» с чертой; в данной работе «аш»– прямое); m е = 9,1 · 10 -31кг – масса электрона; r п – радиус n-й стационарной орбиты; υ n – скорость электрона на этой орбите.
2.7. Атом водорода в квантовой механике
Уравнением движения микрочастицы в различных силовых полях является волновое уравнение Шредингера.
Для стационарных состояний уравнение Шредингера будет таким:
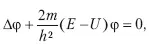
где Δ – оператор Лапласа
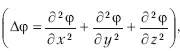
, m – масса частицы, h – постоянная Планка, E – полная энергия, U – потенциальная энергия.
Уравнение Шредингера является дифференциальным уравнением второго порядка и имеет решение, которое указывает на то, что в атоме водорода полная энергия должна иметь дискретный характер:
E 1 , E 2 , E3…
Эта энергия находится на соответствующих уровнях n =1,2,3,…по формуле:
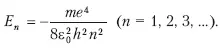
Самый нижний уровень E соответствует минимальной возможной энергии. Этот уровень называют основным, все остальные – возбужденными.
По мере роста главного квантового числа n энергетические уровни располагаются теснее, полная энергия уменьшается, и при n = ∞ она равна нулю. При E>0 электрон становится свободным, несвязанным с конкретным ядром, а атом – ионизированным.
Полное описание состояния электрона в атоме, помимо энергии, связано с четырьмя характеристиками, которые называются квантовыми числами. К ним относятся: главное квантовое число п, орбитальное квантовое число l, магнитное квантовое число m 1 , магнитное спиновое квантовое число m s.
Волновая φ-функция, описывающая движение электрона в атоме, представляет собой не одномерную, а пространственную волну, соответствующую трем степеням свободы электрона в пространстве, то есть волновая функция в пространстве характеризуется тремя системами. Каждая из них имеет свои квантовые числа: п, l, m l .
Каждой микрочастице, в том числе и электрону, также свойственно собственное внутреннее сложное движение. Это движение может характеризоваться четвертым квантовым числом m s. Поговорим об этом подробнее.
A.Главное квантовое число п, согласно формуле, определяет энергетические уровни электрона в атоме и может принимать значения п = 1, 2, 3…
Б.Орбитальное квантовое число /. Из решения уравнения Шредингера следует, что момент импульса электрона (его механический орбитальный момент) квантуется, то есть принимает дискретные значения, определяемые формулой
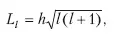
где L l – момент импульса электрона на орбите, l – орбитальное квантовое число, которое при заданном п принимает значение i = 0, 1, 2… (n – 1) и определяет момент импульса электрона в атоме.
B.Магнитное квантовое число m l . Из решения уравнения Шредингера следует также, что вектор L l (момент импульса электрона) ориентируется в пространстве под влиянием внешнего магнитного поля. При этом вектор развернется так, что его проекция на направление внешнего магнитного поля будет
L lz = hm l
где m l называется магнитным квантовым числом, которое может принимать значения m l = 0, ±1, ±2,±1, то есть всего (2l + 1) значений.
Учитывая сказанное, можно сделать заключение о том, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях (n – одно и то же, а l и m l – разные).
При движении электрона в атоме электрон заметно проявляет волновые свойства. Поэтому квантовая электроника вообще отказывается от классических представлений об электронных орбитах. Речь идет об определении вероятного места нахождения электрона на орбите, то есть местонахождение электрона может быть представлено условным «облаком». Электрон при своем движении как бы «размазан» по всему объему этого «облака». Квантовые числа n и l характеризуют размер и форму электронного «облака», а квантовое число m l – ориентацию этого «облака» в пространстве.
Читать дальше
Конец ознакомительного отрывка
Купить книгу