Все, что нас окружает, горные породы и минералы, вещества в атмосфере и в морях, клетки растений и животных, газовые туманности и звезды во Вселенной во всем их многообразии все это состоит из 92 элементарных кирпичиков, химических элементов. Этот факт был установлен наукой девятнадцатого столетия, которая тем самым сильно упростила картину окружающего нас мира. Ученые нашего века в свою очередь показали, что существует всего три типа элементарных частиц, из которых построены атомы этих 92 элементов: протоны, нейтроны и электроны. Так, например, атомы гелия отличаются от атомов углерода только тем, что они состоят из разного количества этих элементарных частиц (рис. 3.1).
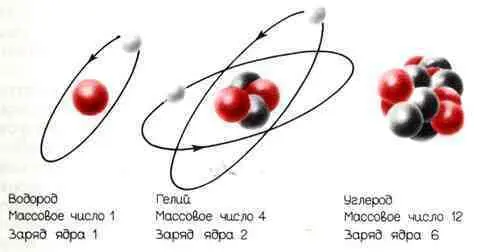
Рис. 3.1. Схема строения атомов водорода, гелия и углерода. Протоны изображены красными шариками, нейтроны — серыми. Траектории электронов (показаны светло-серыми шариками), обращающихся вокруг ядер, изображены в другом масштабе. Шесть электронов, обращающихся вокруг ядра углерода, не показаны.
Атом гелия состоит из ядра, которое содержит два протона и два нейтрона. Протон-это положительно заряженная частица. Поэтому ядро атома гелия тоже заряжено положительно. Вокруг него стремительно вращаются две отрицательно заряженные легкие частицы, два электрона. Они образуют электронную оболочку атома гелия. Атомы углерода обладают более сложной структурой. Они тоже состоят из ядра, которое содержит протоны и нейтроны. Однако в ядре атома углерода уже шесть протонов и шесть нейтронов, а в электронной оболочке находятся шесть электронов. Самым простым атомом является атом водорода. Его ядро состоит всего из одного протона, вокруг которого обращается один электрон.
Протон и нейтрон имеют почти одинаковые массы. Их называют тяжелыми частицами, хотя по сравнению с обычными предметами, которые нас окружают, эти «тяжелые» частицы почти ничего не весят. Если бы мы могли положить на чашу весов триллион таких тяжелых частиц, то они весили бы всего одну триллионную долю грамма. Масса электрона еще в две тысячи раз меньше массы протона. Протон заряжен положительно, электрон — отрицательно. При этом заряды электронов и протонов в точности равны друг другу. Образованный из протона и электрона атом водорода электрически нейтрален. Нейтрон не имеет электрического заряда. Существует также элементарная частица с массой, равной массе электрона, и положительным электрическим зарядом: позитрон. Однако время жизни позитрона невелико: если он приблизится к какому-либо электрону, то электрон и позитрон тут же сливаются друг с другом и аннигилируют с образованием кванта света.
Все атомы и ядра состоят из определенного количества протонов и нейтронов. Сколько протонов находится в ядре, столько же электронов обращается вокруг ядра в электронных оболочках. Поэтому положительный заряд протонов ядра в точности компенсируется отрицательным зарядом электронов. Собственно говоря, дело обстоит еще проще. Если быть точным, то атомы состоят не из трех типов элементарных частиц: протонов, нейтронов и электронов, а всего из двух. В атомных ядрах протоны и электроны могут превращаться в нейтроны. За пределами атомного ядра нейтрон примерно через 17 минут распадается на протон и электрон. Поэтому можно считать, что окружающий нас мир во всем его многообразии построен только из протонов и электронов. Сумма количества протонов и нейтронов в атомном ядре называется массовым числом ядра, а количество протонов — зарядом ядра. Таким образом, атом водорода имеет массовое число 1 и заряд ядра 1. У гелия массовое число равно 4, а заряд ядра 2. Наиболее распространенный тип атомов железа имеет массовое число 56, а заряд ядра 26. Заряд ядра показывает также, сколько электронов должно обращаться вокруг ядра, чтобы атом был полностью электрически нейтральным. Строение электронных оболочек определяет химические свойства веществ. Вещества с различными зарядами ядра различаются по химическим свойствам из-за того, что у атомов этих веществ разные электронные оболочки. Атомы с одинаковым зарядом ядра, но с различным числом нейтронов, не различаются по химическим свойствам. Они различаются только массовым числом. Такие атомы называются изотопами одного и того же элемента. Так, например, кроме обычного водорода существует так называемый тяжелый водород. В ядре этого изотопа кроме одного протона есть еще и один нейтрон. Такой изотоп водорода называется дейтерием. Он в небольших количествах встречается в природе.
Читать дальше









![Эдвард Радзинский - Тираны России и СССР [Распутин. Жизнь и смерть + Сталин. Жизнь и смерть]](/books/391099/edvard-radzinskij-tirany-rossii-i-sssr-rasputin-thumb.webp)

