Механизм мышечного сокращения.Для того чтобы понять сущность процесса сокращения мышечного волокна, необходимо вспомнить, что каждое мышечное волокно состоит из миофибрилл, которые включают в себя повторяющиеся в продольном направлении блоки – саркомеры, отделенные друг от друга так называемыми Z -пластинками (сеть из переплетающихся белковых молекул). Сверху миофибриллы покрыты мембраной мышечного волокна – плазмалеммой, толщина которой порядка 10 нм. Функциональной единицей миофибриллы поперечнополосатой мышцы является саркомер. В обоих направлениях от Z -пластинки тянутся тонкие нити (филаменты), состоящие из белка актина. Они переплетаются с толстыми нитями белка миозина. Миозиновые нити образуют наиболее оптически плотную часть саркомера — А -диск. Светлый участок в середине А -диска называют зоной Н . Здесь находятся только миозиновые нити и нет актиновых. В середине Н -зоны располагается М -линия, в которой находятся ферменты (например, креатиназа), играющие важную роль в энергетическом метаболизме. На участках взаимного перекрытия каждая миозиновая нить окружена шестью актиновыми, а каждая актиновая – тремя миозиновыми. На миозиновых нитях обнаружены мелкие выступы, называемые поперечными мостиками. Они расположены вдоль миозиновых нитей в виде 2-нитчатой спирали. Во время сокращения эти мостики смыкаются с актиновыми нитями. Актиновая нить образована двумя спиральными тяжами из глобулярных молекул актина ( G -актин), закрученными один вокруг другого. В продольных бороздках актиновой спирали находятся нитевидные молекулы белка тропомиозина. Это палочкообразный фибриллярный белок, палочки соединяются конец в конец и образуют два тяжа, закрученных в виде спирали вокруг актина. К каждой молекуле тропомиозина прикреплен комплекс молекул глобулярных белков под общим названием тропонин.
Молекула миозина состоит из двух частей: длинного палочкообразного участка, который подразделяют на шейку и хвост, и глобулярного участка, представленного двумя одинаковыми головками. Диаметр этого участка молекулы составляет 4 нм, длина – 20 нм. Если молекулу миозина обработать протеолитическим ферментом трипсином, то она распадется на две части: легкий меромиозин и тяжелый меромиозин. Последний, в основном образованный головкой и шейкой молекулы, обладает ферментативной и актинсвязывающей активностью. Миозиновые нити формируются объединением отдельных молекул. Хвосты молекул ориентированы к середине, а головки направлены в противоположные стороны и образуют выступы на нити. Молекулы миозина расположены в миозиновой нити так, что головки равномерно распределены по всей длине (кроме небольшого участка в середине).
При наблюдении в микроскоп было обнаружено, что при сокращении ширина А -дисков не изменяется, тогда как I -диски (изотропные) и зоны Н становятся более узкими, т. е. изменяется ширина взаимного перекрытия актиновых и миозиновых нитей. Исходя из этого, A. F. Huxley в 1954 г. предложил для объяснения механизма мышечного сокращения теорию скольжения нитей (рис. 1).
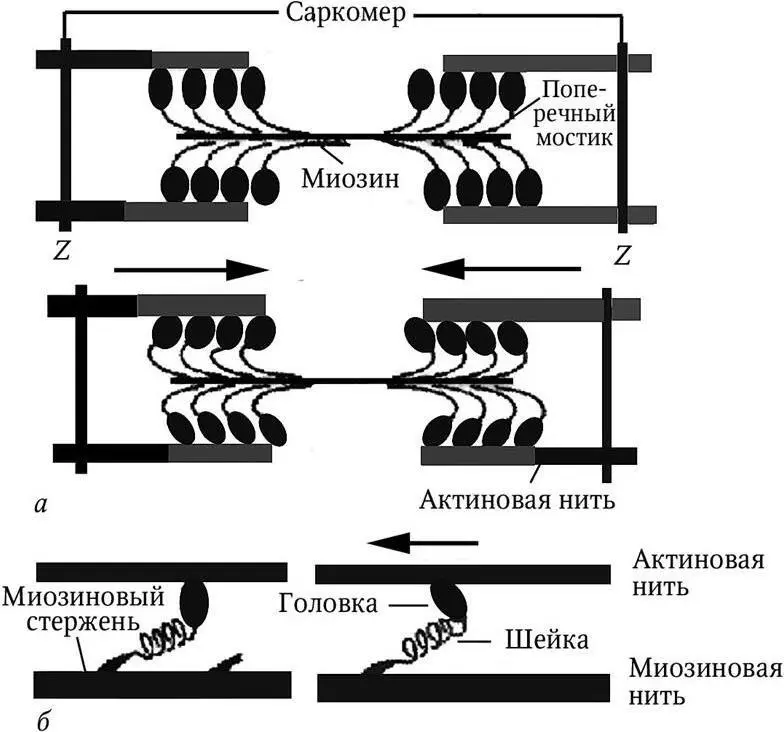
Рис. 1. Модель механизма сокращения – миозиновая нить с поперечными мостиками, прикрепленными к актиновым нитям:
а – схема сокращения мышечного волокна в пределах саркомера; Z – пластинка;
б — схема работы поперечного мостика (единицы соединения актина и миозина)
Согласно теории, укорочение саркомера происходит благодаря активному скольжению тонких актиновых нитей относительно толстых миозиновых в пределах саркомера. Длина самих нитей при этом не изменяется. Во время сокращения каждая головка миозина или поперечный мостик могут связывать миозиновую нить с актиновой. Наклоны головок создают объединенное усилие, и происходит «гребок», продвигающий актиновую нить к середине саркомера. Биполярная организация молекул миозина обеспечивает возможность скольжения актиновых нитей в противоположном направлении в обеих половинах саркомера.
Механизм этого процесса может быть объяснен за счет электромеханического сопряжения, т. е. передачи сигнала возбуждения с мембраны на миофибриллы. Ключевую роль при этом играют ионы Са 2+. В расслабленном состоянии, т. е. при низкой концентрации ионов Са 2+, регуляторные белки – тропомиозин и тропонин C – блокируют прикрепление поперечных мостиков миозина к актиновым нитям. Возбуждение вызывает высвобождение ионов Са 2+из саркоплазматической сети. Это ведет к тому, что концентрация Ca при возбуждении внутри волокна увеличивается и ионы Са 2+соединяются с молекулой тропонина. В результате происходит смещение молекулы тропомиозина, что обеспечивает возможность прикрепления миозиновых поперечных мостиков к актиновым нитям. Это конформационное изменение инициирует ряд процессов, приводящих к сокращению мышцы. Следовательно, в покое белки тропонин и тропомиозин препятствуют соединению мостиков миозина с актином. Активация Са 2+ведет к инактивации регуляторных белков, и происходит присоединение мостиков.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













