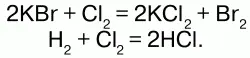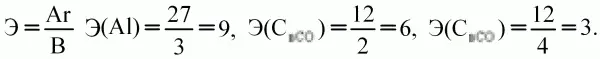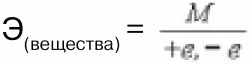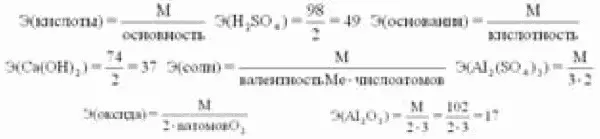Неорганическая химия связана с другими разделами химии – аналитической, коллоидной, кристаллохимией, физической, термодинамикой, электрохимией, радиохимией, химической физикой ; на стыке неорганической и органической химии лежит химия металло-органических соединений и элементооргани-ческих соединений. Неорганическая химия соприкасается с геолого-минералогическими науками : геохимией и минералогией, а также с техническими науками – химической технологией (ее неорганической частью), металлургией и агрохимией.
3. Закон сохранения массы. Основное содержание атомно-молекулярного учения
Атомно-молекулярное учение разработал М.В. Ломоносовв 1741 г. Основные положения закона:
1) все вещества состоят из «корпускул» (молекул);
2) молекулы состоят из «элементов» (атомов);
3) частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц;
4) молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из различных атомов. Атомно-молекулярное учение окончательно утвердилось в 1860 г.
Молекула– это наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее атомным составом и их химическим строением. Атом– это наименьшая электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов и входящая в состав молекул простых и сложных веществ. Закон сохранения массы веществ, позже (в 1748 г.) сформулированный М.В. Ломоносовым, подчинен закону атомно-молекулярно-го учения и объяснен с точки зрения последнего: общее число атомов остается постоянным до и после реакций . Например:
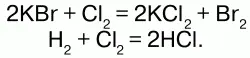
То есть из двух молекул бромида калия и одной молекулы хлора (т. е. в общем из трех молекул) образовалось 2 молекулы хлорида калия и одна молекула брома (т. е. образовалось три молекулы), 3 = 3. Из одной молекулы водорода и одной молекулы хлора – 2 молекулы хлороводорода. А масса веществ до и после реакции не претерпевает изменений, т. к. атомы имеют постоянную массу. Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. В 1789 г.независимо от Ломоносова этот же закон изложил французский ученый и химик Лавуазье. Он также экспериментальным путем получил неопровержимое доказательство закона, проведя опыты с многими реакциями. Закон сохранения массы веществ Ломоносов связывал с сохранением энергии. Он рассматривал эти законы с точки зрения всеобщего закона природы. Закон сохранения массы веществ и закон сохранения энергии – единые законы природы – законы вечной материи и ее движения. Взаимосвязь массы и энергии выражается уравнением Энштейна: Е = mc2, где Е – энергия, m – масса, и с – скорость света в вакууме. Значение закона сохранения массы веществ.Закон сохранения массы веществ позволяет правильно составить уравнение химических реакций, является опорой для осуществления расчетов по химическим уравнениям, позволяет сформулировать представление о всеобщем равновесии материи.
4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
Эквивалент– такое количество вещества (элемента), которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Это величина безразмерная, непостоянная, зависит от ряда факторов: валентности, реакций, в которых участвует вещество:
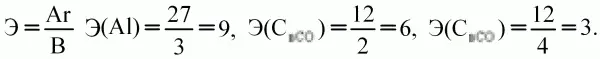
В окислительно-восстановительных реакциях:
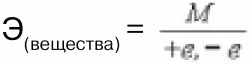
Эквивалент в реакциях нейтрализации зависит от того, какая соль получается в результате реакции (средняя или основная).
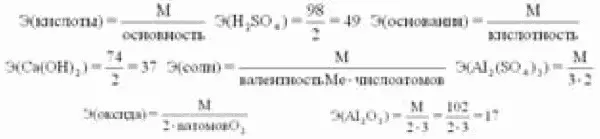
или

Закон эквивалентов открыт в 1873 году Рихтером: вещества взаимодействуют друг сдругом, а также получаются в массовых количествах, пропорциональных их эквивалентам.
Читать дальше
Конец ознакомительного отрывка
Купить книгу