Окись углерода обладает выраженными свойствами восстановителя, ее молекула включает 2 ненасыщенные валентности ( 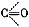 ) и потому может присоединять ряд химических элементов. В этой связи должны быть упомянуты токсичные карбонилы металлов, например соединения окиси углерода с никелем и железом, которые используются в химической промышленности. Поступая в организм, карбонилы выделяют окись углерода:
) и потому может присоединять ряд химических элементов. В этой связи должны быть упомянуты токсичные карбонилы металлов, например соединения окиси углерода с никелем и железом, которые используются в химической промышленности. Поступая в организм, карбонилы выделяют окись углерода:
Ni(СО) 4 → Ni + 4CO.
тeтракарбонил
никеля
Подобная реакция может протекать и при нагревании карбонилов, в особенности на активированном угле и других пористых материалах, а также при воздействии сильных окислителей, например хлора:
Fe(CO) 5 + Cl 2 → 5CO + FeCl 2 .
пентакарбонил
железа
Как это на первый взгляд ни парадоксально, одним из источников окиси углерода является сам человек, организм которого производит я выделяет во внешнюю среду (с выдыхаемым воздухом) за сутки около 10 мл СО. Это так называемая эндогенная, т. е. образующаяся во внутренних средах организма, окись углерода. Многими исследователями было показано, что она отщепляется от молекул гемоглобина при его превращении в желчный пигмент билирубин. [141] Билирубин имеет линейную структуру, которая формируется вследствие разрыва метиновой связи между двумя расположенными рядом пиррольными кольцами гема. При этом выделяется молекула СО.
Поскольку билирубин образуется не только из гемоглобина, но и из других металлопротеидов (цитохромов, миоглобина, порфирина и др.), постольку последние также могут быть источником эндогенной СО. Таким образом, окись углерода является продуктом нормального метаболизма и ее выделение человеком в окружающую среду подобно удалению из организма углекислоты, аммиака и других образующихся в процессе обмена веществ химических соединений.
Хотя первые сведения о существовании эндогенной СО появились в литературе около 85 лет назад, только в последние десятилетия этому факту начали придавать существенное значение, что связано прежде всего с необходимостью обеспечения нормальной воздушной среды для специалистов, длительно находящихся в герметизированных помещениях (кабина самолета и космического корабля, кессон и т. п.). Именно в таких условиях человек вынужден вдыхать воздух, в котором накапливается эндогенная окись углерода, и это может стать причиной аутоинтоксикации. Чтобы предупредить такое опасное явление, необходимо использовать специальные приспособления для поглощения окиси углерода.
Механизм токсического действия окиси углерода
Проникая с атмосферным воздухом в легкие, окись углерода быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окисленным, так и восстановленным гемоглобином по схеме:
Hb 2+ CO  HbCO + O 2
HbCO + O 2
или Hb + СО  HbСО.
HbСО.
Образующийся патологический комплекс карбоксигемоглобин (НbСО) не способен присоединять к себе кислород. При этом в молекуле гемоглобина СО соединяется с атомами железа (карбонил?), вытесняя кислород. Понятно, что одна молекула гемоглобина (точнее, 4 ее гема) может присоединить до 4 молекул СО.
Кровь весьма интенсивно поглощает окись углерода из-за высокого ее химического сродства к гемоглобину. Оказалось, что окись углерода примерно в 250 раз более активно связывается с гемоглобином, чем кислород. Иными словами, в конкуренции за гемоглобин окись углерода имеет выраженное преимущество перед кислородом. Расчет показывает, что при содержании в воздухе 0,07% СО и 21% О 2количество образующегося в крови НbO 2становится равным количеству НbСО. Такое равновесие может установиться, если во вдыхаемом человеком воздухе концентрация окиси углерода, близкая к 0,07% будет поддерживаться в течение многих часов (по некоторым данным, нескольких суток). Вот почему небольшие количества окиси углерода, в том числе эндогенной, могут оказаться опасными при длительном воздействии на организм в замкнутых пространствах. Надо еще иметь в виду, что диссоциация карбоксигемоглобина происходит очень медленно (в 3500 раз медленнее, чем диссоциация оксигемоглобина), и это также способствует его накоплению в крови.
Чем выше концентрация СО в воздухе, тем быстрее достигается опасное для жизни содержание карбоксигемоглобина в крови, составляющее 50% и более по отношению ко всему гемоглобину (рис. 13). Соотношение между количеством в крови НbСО и НbО 2, с одной стороны, и концентрациями СО и О 2во вдыхаемом воздухе — с другой, принято оценивать с помощью константы Дугласа:
Читать дальше
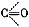 ) и потому может присоединять ряд химических элементов. В этой связи должны быть упомянуты токсичные карбонилы металлов, например соединения окиси углерода с никелем и железом, которые используются в химической промышленности. Поступая в организм, карбонилы выделяют окись углерода:
) и потому может присоединять ряд химических элементов. В этой связи должны быть упомянуты токсичные карбонилы металлов, например соединения окиси углерода с никелем и железом, которые используются в химической промышленности. Поступая в организм, карбонилы выделяют окись углерода: HbCO + O 2
HbCO + O 2 HbСО.
HbСО.








