Представьте себе ряд химических элементов, расположенных в порядке возрастания их атомных весов.
При первом взгляде на такой ряд не видно никакой последовательности в изменении свойств химических элементов. Ни один элемент не походит на своих соседей. Сходство, однако, имеется, но не у элементов, стоящих рядом, а у элементов, разделённых другими, несходными химическими элементами.
ОПЫТЪ СИСТЕМЫ ЭЛЕМЕНТОВЪ,
ОСНОВАННОЙ НА ИХЪ АТОМНОМЪ ВѢСѢ И ХИМИЧЕСКОМЪ СХОДСТВѢ,
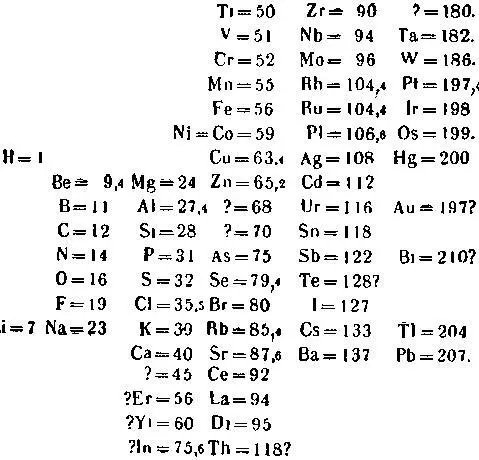
Д. Менделеев!» Рис. 1. Периодическая система химических элементов в том виде, в каком она была впервые опубликована (в 1869 году).
На рисунке 1 приведена периодическая система элементов в том виде, как она была впервые опубликована Д. И. Менделеевым. Вторым по порядку в этой таблице стоит элемент литий (Li). Это — лёгкий, так называемый щелочной металл; соединяясь с водой, он образует щёлочь. За ним следуют шесть элементов, свойства которых иные, чем у лития. Но седьмой элемент, натрий (Na), снова повторяет свойства лития; это — тоже щелочной металл. Ещё через шесть элементов, через период элементов, мы видим новый щелочной металл — калий (К).
Посмотрим, как повторяются свойства соседа лития — лёгкого металла бериллия (Be) — третьего по счёту химического элемента в таблице Менделеева. Оказывается, и здесь его свойства повторяются через тот же период — через шесть элементов находится химический элемент магний (Mg), тоже лёгкий металл, повторяющий в основных чертах свойства своего «родственника». Пропустите ещё шесть элементов, и вы увидите кальций (Са), напоминающий по своим свойствам бериллий и магний.
Таким же образом повторяются свойства бора (В) у элемента алюминия (Al), стоящего на седьмом после него месте, свойства фтора (F) — у хлора (Cl) и т. д.
Такая закономерность наблюдается, однако, не во всём ряду элементов. Начиная с калия, элементы с одинаковыми химическими свойствами располагаются уже не через шесть, а через шестнадцать мест друг от друга [1] В современной периодической таблице Менделеева свойства химических элементов повторяются не через шесть и шестнадцать, а через семь и семнадцать элементов, так как позднее были открыты ещё так называемые инертные газы, занявшие в периодической системе особую группу (см. табл, на стр. 20–21).
.
Подметив эти закономерности, Менделеев разделил весь ряд химических элементов на несколько частей — периодов — и затем расположил эти части одну под другой таким образом, что элементы со сходными свойствами поместились друг под другом, образуя вертикальные столбцы — группы сходных элементов:
литий — 7
бериллий — 9,4
бор — 11
углерод — 12
азот — 14
кислород — 16
фтор — 19
натрий — 23
магний — 24
алюминий — 27,4
кремний — 28
фосфор — 31
сера — 32
хлор — 35,5
и т. д. (цифры обозначают атомные веса элементов).
Свойства элементов в одном периоде изменяются также не случайно. И здесь имеется вполне определённая закономерность. Возьмём тот же период — от лития до фтора. Первым в нём стоит химически активный металл (литий); он легко вступает в соединения с другими веществами; за ним идёт металл, менее химически активный (бериллий); далее стоит элемент ещё менее активный, его металлические свойства выражены ещё слабее (бор). Затем мы видим уже переход от металлов к неметаллам (углерод, азот). Здесь химическая активность элементов идёт по восходящей линии: первый из элементов — азот — наиболее неактивный, следующий — кислород — уже значительно более активный металлоид (металлоид — значит неметалл) и последним стоит очень активный металлоид — фтор.
Чтобы яснее представить, как именно изменяются в периодической таблице свойства элементов по мере увеличения атомного веса, посмотрим, как изменяются некоторые их химические свойства.
Возьмём, например, такое важное химическое свойство, как валентность. Валентностью называется способность атома какого-либо элемента соединяться с определённым числом атомов другого элемента. Наименьшей валентностью обладает атом водорода, поэтому его валентность принята за единицу.
Валентность других химических элементов выражается числом, показывающим, сколько атомов водорода может присоединять или замещать атом того или иного элемента. Если атом элемента присоединяет или замещает один атом водорода, его валентность также равна единице; другими словами, говорят, что данный химический элемент одновалентен; если атом элемента присоединяет или замещает два атома водорода, элемент двухвалентен, и т. д.
Читать дальше
Конец ознакомительного отрывка
Купить книгу






![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/393460/petr-druzhinin-zagadka-tablicy-mendeleeva-istori-thumb.webp)




