В поисках других подобных лучей профессор Беккерель открыл в следующем году вещество, которое самопроизвольно, без влияния внешнего воздействия, испускает лучи, обладающие огромной проникающей способностью. Это было соединение урана. Явление самопроизвольного распада было названо радиоактивностью (излучением).
Вскоре было установлено, что радиоактивность — явление, распространённое в природе. Оно было обнаружено у элементов тория, актиния и других.
М. Складовская-Кюри, исследуя урановую руду, открыла новый элемент — радий, расположенный в современной периодической таблице элементов под номером 88. Изучение его свойств показало, что этот элемент родственен барию.
Была установлена природа радиоактивного излучения. Как оказалось, при радиоактивном распаде вещества выделяются три рода лучей: они были названы альфа-, бета- и гамма-лучами (альфа, бета и гамма — первые буквы греческого алфавита).
Альфа- и бета-лучи отклоняются в магнитном поле и, следовательно, являются электрически заряженными (рис. 4).
Гамма-лучи магнитным полем не отклоняются; по природе они родственны лучам Рентгена.
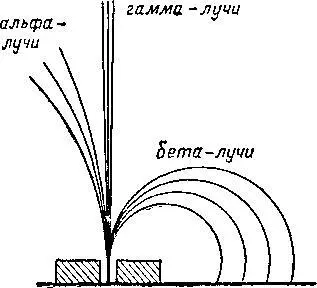
Рис. 4. Излучение радия под действием магнитного поля.
Дальнейшее исследование радиоактивных лучей выявило, что альфа-лучи представляют собой поток положительно заряженных частиц, масса которых равна массе атома гелия. Бета-лучи несут на себе отрицательные электрические заряды. Таким образом, открытие радиоактивных веществ показало, что атом не является простейшей неделимой частичкой.
И действительно, вскоре было установлено, что атом состоит из положительно заряженного ядра, вокруг которого на определённых расстояниях вращаются отрицательно заряженные частицы — электроны. Электроны образуют так называемые электронные оболочки атома. Заряд ядра атома уравновешивается суммой зарядов находящихся в нём электронов.
Хотя ядро атома занимает ничтожно малую часть объёма атома, в нём сосредоточена почти вся его масса.
Самый простейший атом — атом водорода. Он имеет ядро, несущее на себе один положительный заряд, и один электрон, который вращается вокруг ядра.
Электроны располагаются в атомах как бы по слоям, распределены в них на определённых уровнях, причём в каждом слое может находиться только определённое число электронов. Например, первый слой «вмещает» всего два электрона, второй — восемь и т. д.
Атомы, как уже говорилось, в целом электронейтральны. Однако при известных условиях они способны терять из внешней оболочки свои электроны или, наоборот, захватывать на свою внешнюю оболочку «чужие» электроны. В этом случае атом становится электрически заряженной частичкой — ионом.
Притягиваясь друг к другу, различно заряженные ионы — положительные и отрицательные — и образуют молекулы сложных веществ.
Металлы относятся к элементам, которые легко отдают свои электроны. Наоборот, неметаллы — металлоиды — стремятся «захватить» во внешнюю оболочку «лишние» электроны.
Некоторые элементы имеют свойства как металлов, так и неметаллов. Их называют амфотерными.
Способность отдельных атомов отдавать определённое число электронов или присоединять их и определяет валентность химических элементов.
Исследования строения атома показали связь между химическими свойствами элементов и строением электронных оболочек атома.
Возьмём для примера химический элемент литий (Li), начинающий второй период. В его электронной оболочке имеется три электрона. Два из них располагаются в первом слое, а третий образует новый слой, удалённый от ядра на большее расстояние. Этот последний электрон менее устойчив в системе; атом может легко его отдать, превращаясь при этом в положительно заряженную частицу — положительный ион.
Благодаря этому литий и принадлежит к химически активным элементам.
У каждого следующего за литием элемента — вплоть до неона — во внешнем электронном слое прибавляется по одному электрону. Неон завершает собой второй период таблицы Менделеева; в его внешнем электронном слое все восемь мест оказываются занятыми. У неона очень трудно «изъять» любой из восьми электронов его наружного электронного слоя.
Именно поэтому неон и является инертным газом: только с большим трудом он вступает в химические соединения с другими элементами.
Читать дальше
Конец ознакомительного отрывка
Купить книгу







![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/393460/petr-druzhinin-zagadka-tablicy-mendeleeva-istori-thumb.webp)




