Максимальная концентрация SO 2в воде при атмосферном давлении 22,8 %. Повышая давление, можно довести концентрацию до 24–25 % SO 2. При дальнейшем повышении содержания SO 2раствор распределяется на два слоя: нижний — жидкий 98,6 % SO; и верхний раствор, содержащий 24–25 % SO 2. Повысить содержание SO 2до 29,2 % можно охлаждением раствора до -3°. При температуре -3,5° раствор замерзает. Однако растворы указанных выше концентраций практического применения не имеют. Обычно концентрация водного раствора SO 2, используемого, например, на второй ступени варки ацетатной целлюлозы, не превышает 7–10 %.
Варочная кислота для кислой сульфитной варки состоит из бисульфитного раствора и свободного SO 2, а для бисульфитной арки — без свободного SO 2, поэтому в производственных условиях приходится иметь дело с абсорбцией SO 2растворами бисульфита.
Естественно, что в данном случае на насыщение растворов оказывает влияние, кроме температуры, давления и концентрации SO 2, концентрация самого бисульфита. На рис. 6 приведена номограмма для определения теоретического содержания всего SO 2в кислоте (т. е. того количества SO 2, которое может быть поглощено при заданной температуре кислоты), содержание CaO в ней и концентрации SO 2в газе (парциальном давлении). По номограмме находим (пунктирная линия), что при температуре 25° и парциальном давлении 0,1 ата (концентрация печного газа 10 %) в растворе, содержащем 1,2 % CaO, может раствориться 3,44 % SO 2. Подобным образом по номограмме может быть определен состав сырой кислоты при разных условиях.
Из номограммы видно, что с повышением количества основания в кислоте растворимость SO 2в растворе бисульфита возрастает. Однако одновременно с этим содержание свободного SO 2уменьшается. Так, в приведенном выше случае при содержании в растворе 1,37 % связанного SO 2(1,2 % CaO) в виде бисульфита Ca(HSO 3) 2будет находиться 2,74 % SO 2, а свободного SO 21,7 %. При тех же условиях, но при содержании связанного SO 21,6 % (1,4 % CaO) или 3,2 % в виде бисульфита, общее SO 2будет составлять 3,92 %, т. е. растворенного SO 2из них всего 0,72 %.
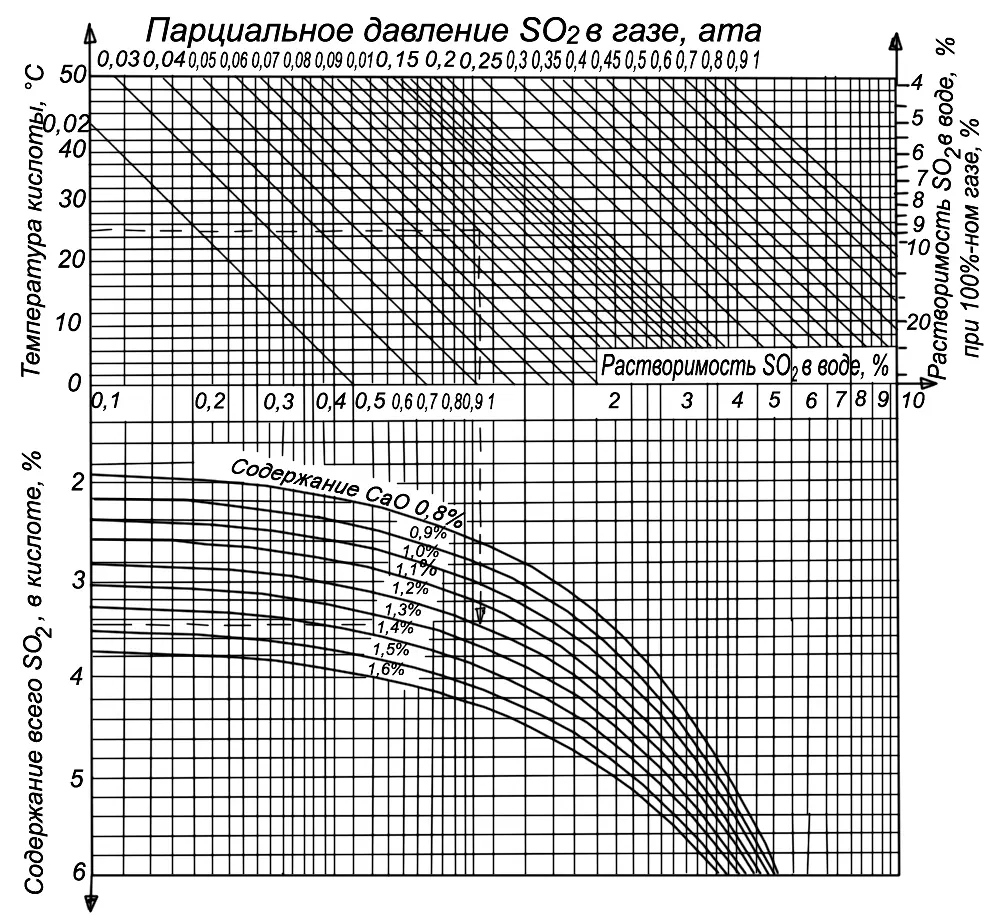
Рис 6. Номограмма для определения содержания SO 2в башенной кислоте.
Дальнейшее увеличение содержания основания в кислоте при данном парциальном давлении возможно только до некоторого предела, называемого равновесным состоянием. Переход через его границы вызовет выпадение из раствора моносульфита CaSO 3. Для устойчивости бисульфита кальция в растворе обязательным является наличие некоторого избытка свободного SO 2, соотношение между общим и связанным SO 2всегда должно быть больше 2.
Растворы бисульфита магния устойчивы и без избыточного SO 2; наряду с бисульфитом Mg(HSO 3) 2может содержаться и некоторое количество моносульфита MgSO 3, а отношение общего SO 2к связанному в равновесном растворе будет всегда около 1,95. Такое положение определяется большей растворимостью бисульфита магния. Растворимым является и моносульфит, причем его растворимость растет с повышением температуры и зависит от концентрации общего SO 2в кислоте. При температуре ниже 43° растворимость MgSO 3понижается с увеличением концентрации общего SO 2до определенного предела, а за тем начинает расти. При температуре выше 43° растворимость растет с повышением содержания общего SO 2. Такое явление объясняют тем, что в первом случае определяющей является растворимость SO 2в воде, во втором в Mg(HSO 3) 2.
Моносульфиты натрия и аммония хорошо растворимы вводе, и так как в растворах, применяемых в производстве, содержание основания ограничено — получение в этом случае растворов, насыщенных по сульфиту, исключено.
Свойства насыщенных по сульфиту растворов определяются видом основания, т. е. парциальное давление SO 2над такими растворами различно при одном и том же содержании связанного и общего SO 2. При наличии избыточного SO 2в растворе эти индивидуальные свойства бисульфитов исчезают и парциальное давление при данной температуре и содержании связанного SO 2определяется только содержанием свободного SO 2в растворе.
Таким образом, приготовление кислоты можно представить в виде следующих последовательно протекающих процессов.
1. На кальциевом основании. Турменный способ основан на поглощении сернистого газа в башнях (турмах), заполненных известковым камнем (СаСО з). Вода, подаваемая в турму, поглощает SO 2с образованием сернистой кислоты по реакции
SO 2 + Н 2O → H 2SO 3.
Читать дальше











