По мере выгорания водорода в центре звезды усиливается гравитационное сжатие и при достижении степени сжатия силовых нитей до 0,16 10 —25 м два ядра гелия начинают сближение и сливаются в определенном положении, образуя ядро изотопа бериллия 8Be. У изотопа атома бериллия две энергетические оболочки q и f. (Рис.1.b). В каждой оболочке находится по два протона и по два нейтрона, которые взаимодействуют с электронами, находящимися на орбиталях с различными энергетическими показателями. Электроны, управляемые протонами второй оболочки, находятся на орбитали 1s 22s 2и обладают большей энергией, чем два других электрона. Они имеют высокую валентную способность, поэтому бериллий химически активный элемент. Из всех изотопов 8Be один стабилен. Его распространенность составляет 100%.
Когда в центре звезды температура достигнет 10 8 К, а степень сжатия силовых нитей составит 10 —26 м, начинается сближение ядер бериллия
ядрами гелия. Сливаются ядра гелия в определенной последовательности и в результате три ядра гелия превращаются в одно ядро углерода 12C. Ядро этого изотопа углерода, как и ядро изотопа бериллия имеет две ядерные оболочки, но у него в этой оболочке находятся не два, а четыре протона (Рис.1.c). Изотоп стабилен и имеет большое распространение. Внешние электроны атома углерода занимают электронную орбиталь 2p, но пространственная ориентация внешнего электронного слоя при возбуждении атома делает возможным промотирование одного из спаренных электронов с орбитали 2s на орбиталь 2 p. В результате углерод образует обширные химические связи.
Ядра атома кислорода начинают формироваться в ядерной топке звезд, когда температура превысит 10 8 К, а степень сжатия силовых нитей составит 0,31 10 —27 м. Образовываться они будут путем присоединения ядер гелия к ядрам углерода. Присоединение будет происходить направленно с образованием определенной формы ядра, при которой каждый протон будет взаимодействовать только с соседними нуклидами и с электронами определенной орбитали. Итогом этого процесса будет синтез изотопа кислорода 16O. Он стабилен и широко представлен в природе. после водорода и гелия. У него две ядерных оболочки. Во второй оболочке изотопа функционируют шесть протонов. (Рис.1. d). Четыре из них деформируют (сжимают) силовые нити пространства внешнего электронного слоя и создают пространственную направленность действия валентной орбитали 2p. Все это в совокупности делает кислород одним из самых агрессивных химических элементов. По химической активности кислород уступает только фтору.
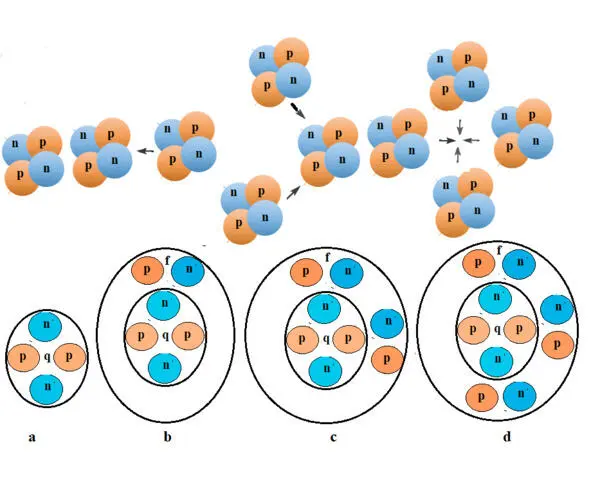
Рис. 1. Схема образования ядер бериллия, углерода и кислорода путем слияния ядер гелия, b – ядро бериллия, с – ядро углерода, d – ядро кислорода
Истощение запасов атомов гелия и углеродв внутри звезды вызывает её гравитационное сжатие, что приводит к дальнейшему росту температуры и степени сжатия силовых нитей в её центре. При достижении степени сжатия 0.24 10 —27 м начинается слияние ядер кислорода и ядер гелия. Ядра гелия присоединяются к ядрам кислорода таким образом, что в результате синтезируются ядра изотопа неона со своеобразной, только им присущей конфигурацией. У ядра атома неона 20Ne имеется две ядерных оболочки, но в отличие от ядер атомов других элементов, его вторая атомная оболочка полностью заполнена нуклидами (Рис.2.e), поэтому ядро неона обладает повышенной устойчивостью. У атома неона на внешней электронной валентной орбитали 2p нет свободных электронов, они все спаренные, поэтому атом неона химически инертен.
С выгоранием углеродно – кислородного ядра в центре звезды продолжается рост температуры и степени сжатия силовых нитей и при достижении ею величины 0,24 10 —27м начинается горение ядер неона. Оно сопровождается отрывом от ядер неона α -частиц (ядер гелия) и последующим присоединением их к другим ядрам неона. В результате присоединения одной α -частицы образуется ядро магния, двух ядро кремния. Присоединение происходит также, как и в предыдущих синтезах новых элементов, направлено с образованием определенной конфигурацией ядра. Изотоп ядра кремния 28Si имеет три энергетические оболочки (Рис.2.k) В третьей (y) оболочке находятся 4протона и 4 нейтрона. Протоны взаимодействуют с двумя электронами внешней валентной орбитали 3p, а также у него два спаренных электрона на орбитали3s промотируют на вакантную орбиталь 3d, потому кремний четырехвалентен. Это дает возможность атому кремния проявлять себя как химически активный элемент. Кремний является одним из широко распространен ным элементом в природе.
Читать дальше