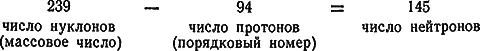Развитие науки и техники в XX веке вооружило человека такими средствами, которые позволили разрушить и преобразовать в другие виды материи ряд элементарных частиц. Электроны и позитроны при взаимодействии могут превращаться в гамма-кванты. Протон имеет сложное строение. Установлено, что нейтрон радиоактивен и способен распадаться с образованием протона, электрона и нейтрино. В 1955 и 1956 гг. удалось в лаборатории получить новые, предсказанные учеными элементарные частицы — антипротон, масса которого равна массе протона, но его заряд — отрицательный, и антинейтрон— частицу, подобную нейтрону, но отличающуюся от него некоторыми ядерными свойствами. Предела делимости материи не существует. Следовательно, и электрон и другие элементарные частицы не являются неделимыми по своей природе.
Ядра всех атомов построены из протонов и нейтронов. Число протонов в ядре, определяющее его положительный заряд, равно порядковому номеруэлемента (в периодической системе). Сумма чисел протонов и нейтронов определяет вес ядра и называется массовым числом.
Зная массовое число и порядковый номер, легко определить число протонов и нейтронов в ядре атома. Если, например, известно, что порядковый номер фосфора равен 15, а его массовое число — 31, то в ядре фосфора содержится 15 протонов и 31-15=16 нейтронов. Если массовое число урана равно 238, а его порядковый номер — 92, то это значит, что в ядре урана содержится 92 протона и 146 нейтронов.
Каждый химический элемент характеризуется определенным порядковым номером. Это объясняется тем, чго число протонов в ядрах атомов каждого элемента строго определенно. Что же касается числа нейтронов, то оно может изменяться в некоторых пределах.
Поэтому могут существовать разновидности атомов одного и того же элемента, отличающиеся друг от друга массовым числом. Такие разновидности помещаются в одной и той же клетке таблицы Д. И. Менделеева и называются изотопамиэтого элемента. Слово «изотоп» происходит от двух греческих слов: «изос» — одинаковый и «топос» — место.
Многие природные элементы являются смесью нескольких изотопов. Простейший элемент водород оказался смесью приблизительно 99,98% легкого изотопа водорода ( протия) и 0,02% тяжелого изотопа водорода ( дейтерия). Известен также третий радиоактивный изотоп водорода — тритий. Ядро протия — не что иное, как протон. Ядро дейтерия состоит из одного протона и одного нейтрона, т. е. его массовое число равно двум. Ядро трития состоит из одного протона и двух нейтронов (рис. 3).
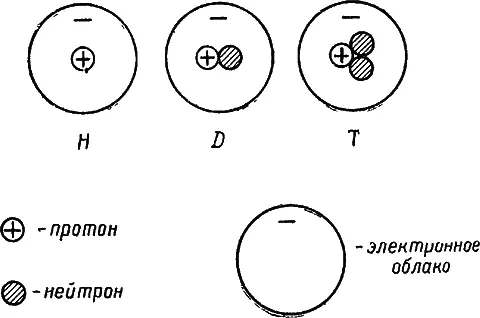
Рис. 3. Схема строения атомов изотопов водорода:
Н — протий; D — дейтерий; Т — тритий
В ядрах атомов гелия, порядковый номер которого равен 2, содержится, разумеется, 2 протона, но число нейтронов может быть равно 1 или 2. В природе действительно существуют два изотопа гелия с массовыми числами 3 и 4. Количество легкого изотопа гелия на Земле очень мало по сравнению с количеством тяжелого. Элемент литий характеризуется порядковым номером 3. В природе существуют два изотопа лития с массовыми числами 6 и 7; их называют литий 6 и литий 7.
В ядре атома тория (элемента № 90) имеется 90 протонов и 142 нейтрона, атомный вес его равен 232. Ядро атома одного из изотопов плутония (элемента № 94) содержит 94 протона и 145 нейтронов. Число нейтронов можно определить вычитанием числа протонов из общего числа частиц ( нуклонов), равного массовому числу.
Для упомянутого изотопа плутония расчет будет таким:
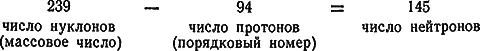
Для краткости изотопы обозначаются так же, как элементы — латинскими буквами. Слева внизу ставится порядковый номер, а справа вверху — массовое число изотопа. Например, протий, дейтерий и тритий обозначаются: 1H 1, 1Н 2и 1Н 3(иногда дейтерий и тритий обозначаются D и Т). Изотопы лития обозначаются 3Li 6и 3Li 7. Известны элементы, которые имеют только один природный изотоп. К числу таких элементов относится, например, фосфор, имеющий лишь один природный изотоп 15P 31. Некоторые элементы являются смесью большого числа изотопов, например, природное олово — смесь 10 изотопов.
Радиоактивность
В природе существуют химические элементы, которые испускают невидимые лучи, действующие даже сквозь непрозрачную бумагу на фотографическую пластинку. Если такую облученную фотографическую пластинку проявить, то она почернеет. Элементов, самопроизвольно испускающих лучи, известно довольно много: уран, радий, торий, радон и ряд других. Изотопы одного и того же элемента могут испускать неодинаковые лучи. Известны такие случаи, когда один из изотопов элемента испускает невидимые лучи, а другие не испускают. Например, у калия из трех его природных изотопов 19К 39, 19К 40и 19К 41только 19К 40испускает лучи.
Читать дальше