Статья Праута была очень убедительна,- многие поверили в то, что водород есть действительно «первичное вещество», из которого состоит все на свете. Одна только была беда - те химические анализы, основываясь на которых Дальтон вычислил свои атомные массы, были очень уж неточны: Дальтон был, правду сказать, плохой экспериментатор. Если провести анализы тщательнее и вычислить атомные массы точнее, то окажутся ли они по-прежнему целыми числами?
За грандиозную работу точного определения атомных масс и точного анализа состава химических соединений взялся знаменитый шведский химик Пенс Якоб Берцелиус. Берцелиусу, больше чем кому-нибудь другому, химия обязана тем, что она стала точной наукой. Берцелиус был убежденнейшим сторонником атомистической теории Дальтона, которую он называл «одним из величайших успехов химии». Но в других отношениях он многого не мог простить Дальтону. «Следует упрекнуть Дальтона в том,- писал Берцелиус,- что он чересчур доверял своей собственной гипотезе и мало подвергал ее экспериментальной проверке. Можно подумать, что даже в тех немногочисленных химических анализах, которые производил Дальтон, он руководствовался желанием получить определенный результат, а ведь такого способа действий всегда нужно остерегаться, особенно если цель опытов - получить решающее доказательство в пользу или против какого-нибудь предвзятого теоретического мнения». И Берцелиус вооружился самой точной химической аппаратурой, какую только он мог достать или построить, и принялся за свои анализы. В течение своей жизни Берцелиус проанализировал больше двух тысяч различных химических соединений, и результаты его анализов отличаются от самых точных теперешних результатов не больше чем на 1-2% (попутно Берцелиус открыл и несколько химических элементов, до него неизвестных: селен, кремний, циркон [ 4 ] Церий. (Прим. ред.)
, торий, тантал). Вычисляя атомные массы, Берцелиус никогда не определял состав молекулы анализируемого вещества наугад, как это делал Дальтон, предположивший «для простоты», что молекула воды имеет состав 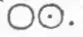 , а молекула аммиака - состав
, а молекула аммиака - состав  (т. е. что каждая из этих молекул состоит из двух атомов). Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех - одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов - одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры - атомные массы - оказались сплошь неверны. Берцелиус опубликовал свои атомные массы два раза. Один раз в 1818 году он выпустил таблицу атомных масс, основанную на химических анализах, которые представляли рекорд возможной тогда в химии точности (но, все же в атомных массах, выведенных из этих анализов, еще было очень много ошибок вследствие неверных формул состава молекул). В 1826 году Берцелиус опубликовал новую таблицу, в которой он побил свои собственные рекорды точности. Атомные массы, которые были помещены в этой таблице, в громадном большинстве случаев очень близки к тем, которые приняты в химии и теперь.
(т. е. что каждая из этих молекул состоит из двух атомов). Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех - одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов - одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры - атомные массы - оказались сплошь неверны. Берцелиус опубликовал свои атомные массы два раза. Один раз в 1818 году он выпустил таблицу атомных масс, основанную на химических анализах, которые представляли рекорд возможной тогда в химии точности (но, все же в атомных массах, выведенных из этих анализов, еще было очень много ошибок вследствие неверных формул состава молекул). В 1826 году Берцелиус опубликовал новую таблицу, в которой он побил свои собственные рекорды точности. Атомные массы, которые были помещены в этой таблице, в громадном большинстве случаев очень близки к тем, которые приняты в химии и теперь.
Небольшую путаницу, которая еще оставалась у Берцелиуса, устранил в 1860 году итальянский химик Станислав Канниццаро; собравшийся 3 сентября 1860 года в Карлсруэ Международный конгресс химиков принял систему относительных атомных масс, предложенную Канниццаро, и этот момент принято считать началом современной химии.
Мы приведем таблицу химических элементов и их атомных масс, принятую в настоящее время [ 5 ] См, примечание на следующую таблицу (Примеч. ред.)
. Заметим только, что теперь в качестве единицы атомной массы уже больше не принимают массу атома водорода, как предлагал в свое время Дальтон.
Сейчас атомная единица массы (а.е.м.) выбрана так, чтобы масса атома самого распространенного изотопа углерода была в точности равна 12 а.е.м. Масса атома водорода оказалась при этом чуть больше 1 а.е.м.
В таблицах обычно указывают относительную атомную массу химического элемента - отношение массы атома элемента к атомной единице массы. Эта система единиц принята и в той таблице, которую мы приводим. Что касается указанных там же значков (символов) химических элементов, то они уже нисколько не похожи на кружки Дальтона. Берцелиус предложил - и это было принято огромным большинством химиков, а потом и всеми без исключения - применять в качестве значка химического элемента начальную букву или две буквы его латинского названия (например, водород обозначать буквой Н от латинского Hydrogenium, азот - буквой N от латинского Nitrogenium, железо - значком Fe от Ferrum, медь - Cu - от Cuprum, углерод - С от Carbo и т. д.). Когда нужно обозначить молекулу, то, если в ней есть несколько атомов одного и того же химического элемента, обозначение этого атома не повторяется, как это делал Дальтон, изображавший, молекулу углекислого газа в виде  ,а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO 2(С - углерод, О - кислород), молекула воды записывается Н 2O, молекула аммиака - NH 3и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С 12Н 22О 11(12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа - все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения
,а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO 2(С - углерод, О - кислород), молекула воды записывается Н 2O, молекула аммиака - NH 3и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С 12Н 22О 11(12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа - все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения
Читать дальше

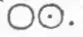 , а молекула аммиака - состав
, а молекула аммиака - состав  (т. е. что каждая из этих молекул состоит из двух атомов). Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех - одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов - одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры - атомные массы - оказались сплошь неверны. Берцелиус опубликовал свои атомные массы два раза. Один раз в 1818 году он выпустил таблицу атомных масс, основанную на химических анализах, которые представляли рекорд возможной тогда в химии точности (но, все же в атомных массах, выведенных из этих анализов, еще было очень много ошибок вследствие неверных формул состава молекул). В 1826 году Берцелиус опубликовал новую таблицу, в которой он побил свои собственные рекорды точности. Атомные массы, которые были помещены в этой таблице, в громадном большинстве случаев очень близки к тем, которые приняты в химии и теперь.
(т. е. что каждая из этих молекул состоит из двух атомов). Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех - одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов - одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры - атомные массы - оказались сплошь неверны. Берцелиус опубликовал свои атомные массы два раза. Один раз в 1818 году он выпустил таблицу атомных масс, основанную на химических анализах, которые представляли рекорд возможной тогда в химии точности (но, все же в атомных массах, выведенных из этих анализов, еще было очень много ошибок вследствие неверных формул состава молекул). В 1826 году Берцелиус опубликовал новую таблицу, в которой он побил свои собственные рекорды точности. Атомные массы, которые были помещены в этой таблице, в громадном большинстве случаев очень близки к тем, которые приняты в химии и теперь. ,а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO 2(С - углерод, О - кислород), молекула воды записывается Н 2O, молекула аммиака - NH 3и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С 12Н 22О 11(12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа - все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения
,а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO 2(С - углерод, О - кислород), молекула воды записывается Н 2O, молекула аммиака - NH 3и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С 12Н 22О 11(12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа - все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения





![Матвей Бронштейн - Солнечное вещество и другие повести, а также Жизнь и судьба Матвея Бронштейна и Лидии Чуковской [сборник]](/books/431099/matvej-bronshtejn-solnechnoe-vechestvo-i-drugie-poves-thumb.webp)




