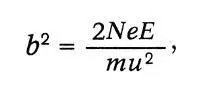Рис. 65. Лаборатория Резерфорда в Кембридже
Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния ф.
Рис. 48. Схема масс-спектрометра Астона
7 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и в-лучей и строение атома». В докладе он, в частности, говорил: «Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома а- и в-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов n в единице рассеивающего материала, толщине рассеивающей пластинки и величине b 2, выражаемой следующей формулой:
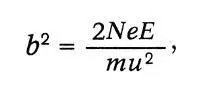
где Ne — заряд в центре атома, Е — заряд отклоняемой частицы, m — ее масса, u — ее скорость. Кроме того, эта вероятность зависит от угла рассеяния Φ , так что число рассеянных частиц на единицу площади пропорционально (cosec)4 Ф/2
Этот «закон косеканса» был проверен экспериментально Гейгером и был найден справедливым в пределах экспериментальных ошибок.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ± Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено, — писал Резерфорд, — но для атома золота оно приблизительно равно 100 единицам заряда».


В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам «Это была трудная, кропотливая работа, — характеризовал Резерфорд работу своих сотрудников, — так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 г. считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.

Рис. 67. Здание каведишской лаборатории
Заряд ядра оказался важнейшей характеристикой атома. Бор вспоминал, что в 1912—1913 гг. «в центре интересов всей манчестерской группы было исследование многочисленных следствий открытия атомного ядра». Далее он писал: «С самого начала было ясно, что благодаря большой массе ядра и его малой протяженности в пространстве сравнительно с размерами всего атома строение электронной системы должно зависеть почти исключительно от полного электрического заряда ядра. Такие рассуждения сразу наводили на мысль о том, что вся совокупность физических и химических свойств каждого элемента может определяться одним целым числом...»
В 1913 г Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же 1913 г. ф. Содди и К. фаянс пришли к закону смещения Содди — фаянса, согласно которому при а-распаде радиоактивный продукт смещается в менделеевской таблице на два номера выше, а при (3-распаде — на номер ниже. С точки зрения представления о номере элемента как о заряде ядра этот закон получает простое истолкование. К этому же времени Содди пришел к представлению об изотопах как разновидностях одного и того же элемента, ядра атомов которых имеют одинаковый заряд, но разные массы.
Читать дальше