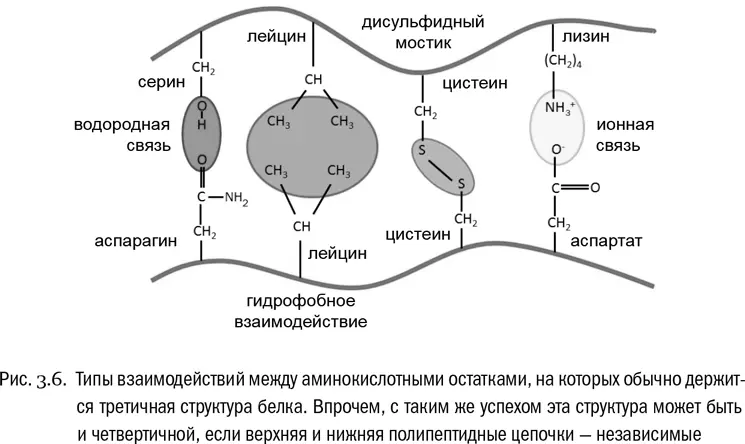
Наконец, четвертичная структура возникает в том случае, если функциональный белок собирается из нескольких отдельных полипептидных цепей (см. рис. 3.7Б). Если белок состоит из одной полипептидной цепи, значит, четвертичной структуры у него нет. Взаимодействия, создающие четвертичную структуру, те же самые, что и в третичной структуре, только не внутри одной полипептидной цепи, а между разными цепями.
Типичный белок с четвертичной структурой — гемоглобин, переносящий кислород в нашей крови. Его молекула состоит из четырех полипептидных цепочек, которые синтезируются отдельно, но свою функцию выполняют только вместе. Объединяются они в основном за счет гидрофобных взаимодействий. Всего молекула нормального гемоглобина взрослого человека включает 574 аминокислоты.
Потеря белком своей пространственной структуры без разрушения пептидных связей (то есть первичной структуры) называется денатурацией , что буквально значит «потеря природы» (см. рис. 3.7В). Самый простой способ денатурировать белок — как следует нагреть его. Именно частичная денатурация белков является основной целью любой тепловой обработки пищи. Причем иногда этот процесс до некоторой степени обратим (при кипячении молока, например). Восстановление пространственной структуры денатурированного белка называется ренатурацией . Но бывает и необратимая денатурация. Например, белок крутого яйца после полной необратимой денатурации растворенных там молекул белков становится твердым, потому что раскрученные полипептидные цепочки перепутываются между собой. Денатурация большинства белков (но не всех!) происходит при температуре 40–50 °C. Это определяет верхний температурный предел для жизни большинства земных живых существ.
Чтобы белок выполнял свою биологическую функцию, нужна, как правило, тончайшая и очень точная «настройка» его пространственной структуры. Нарушения аминокислотной последовательности тем и опасны, что они эту структуру разрушают. Например, существует генетическое нарушение, при котором в строго определенной точке одной из цепей гемоглобина глутамат заменяется на валин. Казалось бы, всего лишь одна аминокислота заменяется на другую. Но здесь это имеет неожиданно серьезные последствия. Глутамат — аминокислота, боковая цепь которой несет отрицательный заряд, валин же нейтрален и гидрофобен. Если рядом окажутся два остатки глутамата, они будут отталкиваться. А если два остатка валина, то, наоборот, слипаться. В данном случае замена глутамата на валин приводит к тому, что слипаться начинают целые молекулы гемоглобина. А это деформирует красные кровяные клетки, в которых он содержится, и вызывает тяжелую болезнь — серповидноклеточную анемию. Именно таков ее молекулярный механизм.
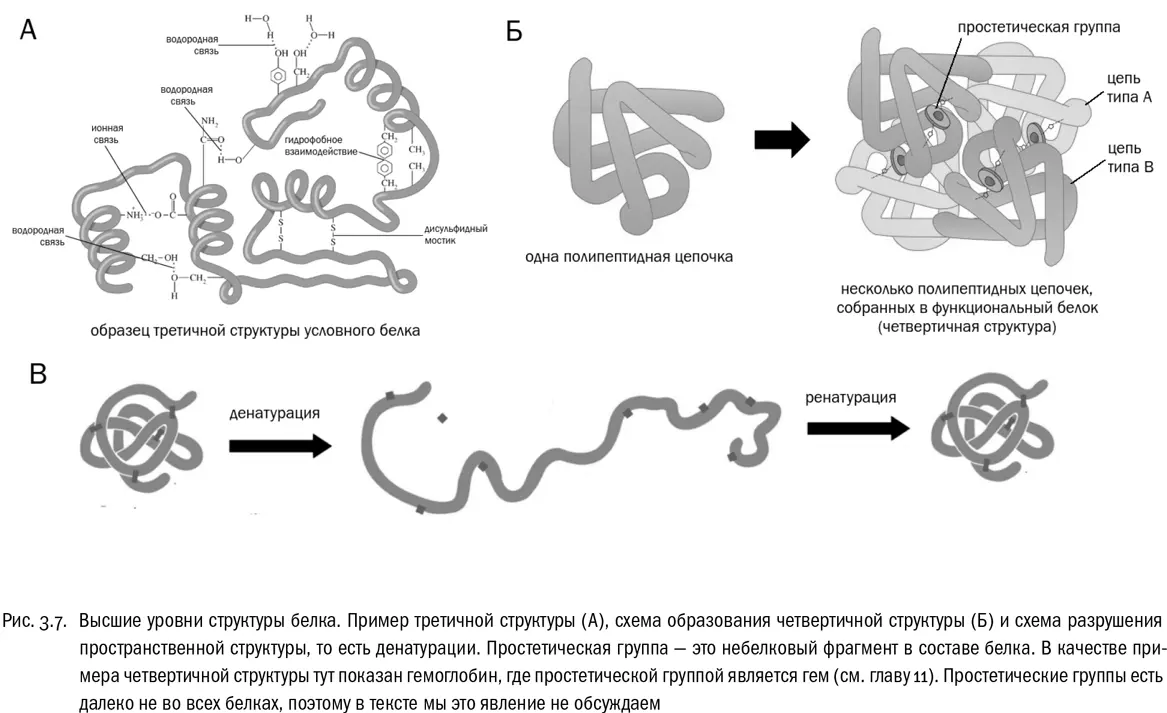
Очевидно, что взаимодействия между аминокислотами в белке неслучайны. Сворачивание белковой молекулы зависит от ее первичной структуры, то есть от того, в каком порядке аминокислоты расположены в цепочке. Иногда говорят, что если бы можно было взять полипептидную цепь за концы, растянуть ее и потом отпустить, то она каждый раз свертывалась бы совершенно одинаково. На самом деле в живой клетке все происходит несколько иначе: там белок синтезируется последовательно, аминокислота за аминокислотой (от N-конца к C-концу), и части молекулы белка, синтезированные раньше, успевают свернуться в трехмерную структуру до того, как будут синтезированы остальные части. Но в итоге все молекулы данного белка сворачиваются строго одинаково. Зная аминокислотную последовательность белка, теоретически можно рассчитать его пространственную структуру всех уровней. Часто это успешно делают и на практике, используя методы таких наук, как биофизика и биоинформатика. В идеале последовательность аминокислот (которую можно записать в строчку, обозначив аминокислоты буквами) должна однозначно определять собой все свойства белка. И более того, изучаемая биологами реальность к этому идеалу очень близка.
Биохимическая эволюция началась еще до образования Земли как планеты. Современные ученые уверены, что синтез веществ, ставших потом биологически активными, шел уже на частицах протопланетного газопылевого облака [29] Пармон В. Н. Новое в теории появления жизни // Химия и жизнь. 2005. № 5.
. Об этом свидетельствует многое — например, химический состав углистых метеоритов, которые потому так и называются, что богаты углеродом (в научной литературе их часто называют углистыми хондритами). Метеориты этого типа никогда не входили в состав планет, поэтому их химический состав не искажен действием высоких температур и давлений, господствующих в планетных недрах. Это своего рода химический «заповедник» очень древней эпохи Солнечной системы — эпохи, когда синтез органических веществ только начинался. Химический анализ углистых метеоритов дал ученым поразительную возможность заглянуть во времена, непосредственно предшествовавшие зарождению жизни.
Читать дальше
Конец ознакомительного отрывка
Купить книгу












