Теперь отмерьте вновь 100 мл второго раствора, а 50 мл первого разбавьте водой ровно вдвое. С секундомером в руках вы убедитесь, что время, прошедшее с момента сливания растворов до их окрашивания, тоже увеличится в два раза.
Наконец, смешайте 100 мл второго раствора с 25 мл первого, разбавленного водой вчетверо, т. е. до тех же 100 мл. «Химические часы» будут работать в четыре раза дольше, чем в первом опыте.
Этот опыт демонстрирует один из фундаментальных химических законов — закон действия масс, согласно которому скорость реакции пропорциональна концентрациям реагирующих веществ. Но вот в чем вопрос: почему растворы окрашиваются мгновенно после паузы, а не равномерно и постепенно, как этого следует ожидать?
Серная кислота в растворе вытесняет йодат- и сульфит-ионы из их солей. При этом в растворе образуется йодоводородная кислота HI, но живет она недолго и тут же вступает во взаимодействие с йодноватой кислотой HJO 3. В результате выделяется свободный йод, он-то и дает цветную реакцию с крахмалом.
Если бы все шло именно так, то раствор и темнел бы постепенно, по мере выделения иода. Однако параллельно идет еще один процесс: сернистая кислота Н 2SO 3реагирует со свободным иодом и вновь образуется иодоводородная кислота. Эта реакция идет быстрее предыдущей, и йод, не успев окрасить крахмал, снова восстанавливается до JO3-.
Выходит, что окраска не должна появиться вовсе? Обратите внимание: в ходе реакции сернистая кислота непрерывно расходуется, и как только вся она превратится в серную, иоду ничто уже не будет мешать реагировать с крахмалом. И тогда раствор мгновенно окрасится по всему объему.
Разбавляя раствор вдвое и вчетверо, вы уменьшали концентрацию иодата калия, и скорость реакции уменьшалась пропорционально.
Объяснение, кажется, заняло больше времени, чем сам опыт с часами…
В химических исследованиях очень часто используют оптические способы. Явление, которое вы сейчас будете наблюдать, применяют для того, чтобы определить температуру плавления вещества.
Подготовьте около пятнадцати одинаковых пластинок из тонкого стекла (годятся, например, старые фотопластинки). Горячей водой смойте с них эмульсию и нарежьте на квадратики размером примерно 5 х 5 см. Десять таких квадратиков положите один на другой и с торцов обмотайте изоляционной лентой, чтобы стопка не рассыпалась. На одну из оставшихся пластинок насыпьте немного тиосульфата натрия (гипосульфита) и аккуратно подогрейте, чтобы кристаллы расплавились. Другую свободную пластинку нагрейте и сразу накройте ею расплав. Между пластинками образуется тонкий прозрачный слой расплавленной соли. Если он окажется мутным, добавьте немного, буквально одну-две капли воды. При остывании расплава на воздухе гипосульфит начнет кристаллизоваться; это само по себе любопытно наблюдать через увеличительное стекло.
Положите на стол лист черной бумаги, а поверх него — чистое тонкое стекло. Включите яркую лампу и сядьте у стола так, чтобы сквозь стопку, которую вы будете держать, было видно отражение лампы в тонком стекле, лежащем на столе. Меняя наклон стопки, наклоняясь ближе к столу, либо отдаляясь от него, найдите такое положение, при котором отраже ние лампы померкнет. На стопку лучше смотреть под острым углом. Если вам мешает прямой свет от лампы, прикройте стопку экраном или ладонью, но так, чтобы видеть свет, отраженный от стола.
Свободной рукой возьмите пластинки с гипосульфитом и поместите их между стопкой и столом так, чтобы они оказались на пути света. Слегка поворачивайте и наклоняйте их — и вы увидите очень красивую радугу.
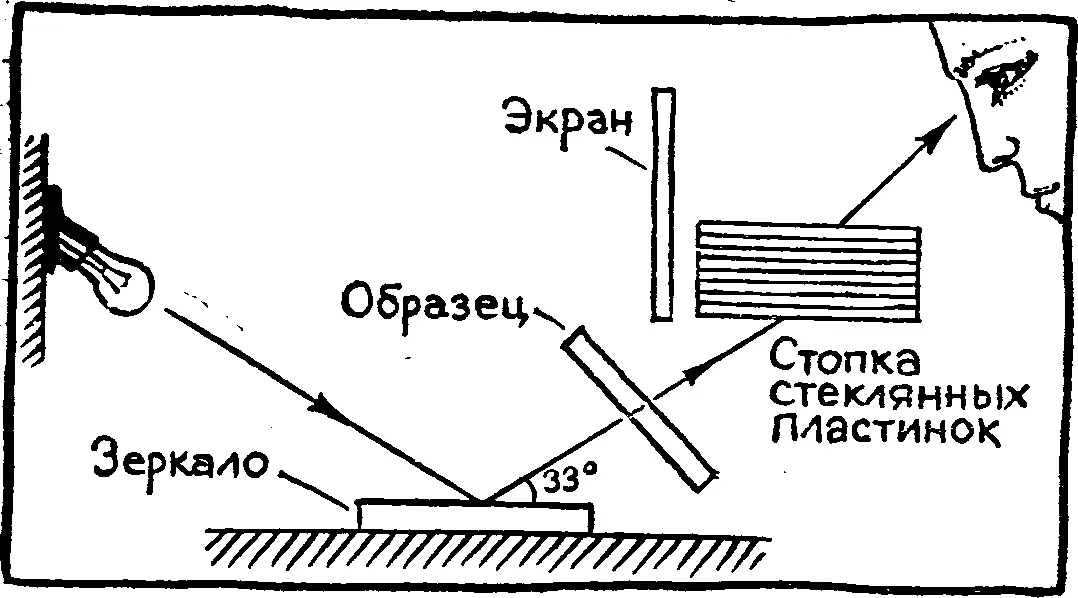
Объяснение опыта завело бы нас в мир уже нс химических, а физических явлений. Расскажем только, как с помощью таких стопок — их называют поляризационными — измеряют температуру плавления. Радуга, которую вы наблюдали, появляется только в кристаллах. Если же постепенно нагревать твердое вещество, то в тот самый момент, когда вещество перейдет в жидкое состояние, радуга исчезнет.
Во время некоторых химических реакций часть энергии выделяется в виде света. Такой процесс называют хемилюминесценцией. Иногда хемилюминесценция происходит в живых организмах: самый наглядный пример — всем известные светляки. Слабое свечение появляется и при окислении некоторых органических соединений. Вы можете наблюдать его в опыте с окислением гидрохинона. Заключительную стадию этого опыта надо проводить в темноте, чтобы свечение было лучше заметно.
Читать дальше












