Наталья Трунилина
Ферменты
Часть первая.
I . Определение. Химическая природа. Понятия: холофермент, апофермент, кофермент, кофактор.
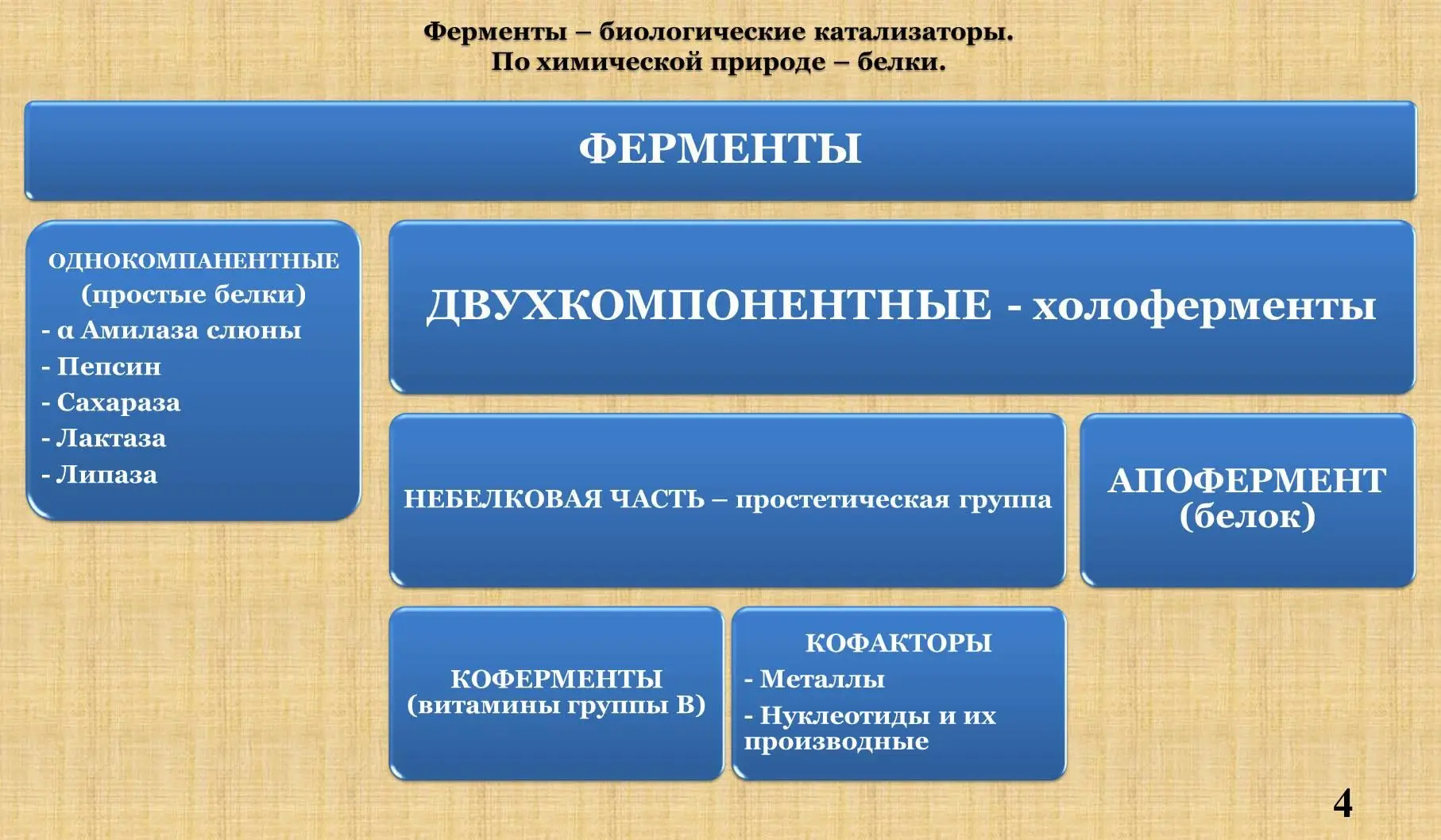


II . Сравнение фермента и небиологического катализатора.
2.1 Общие черты.

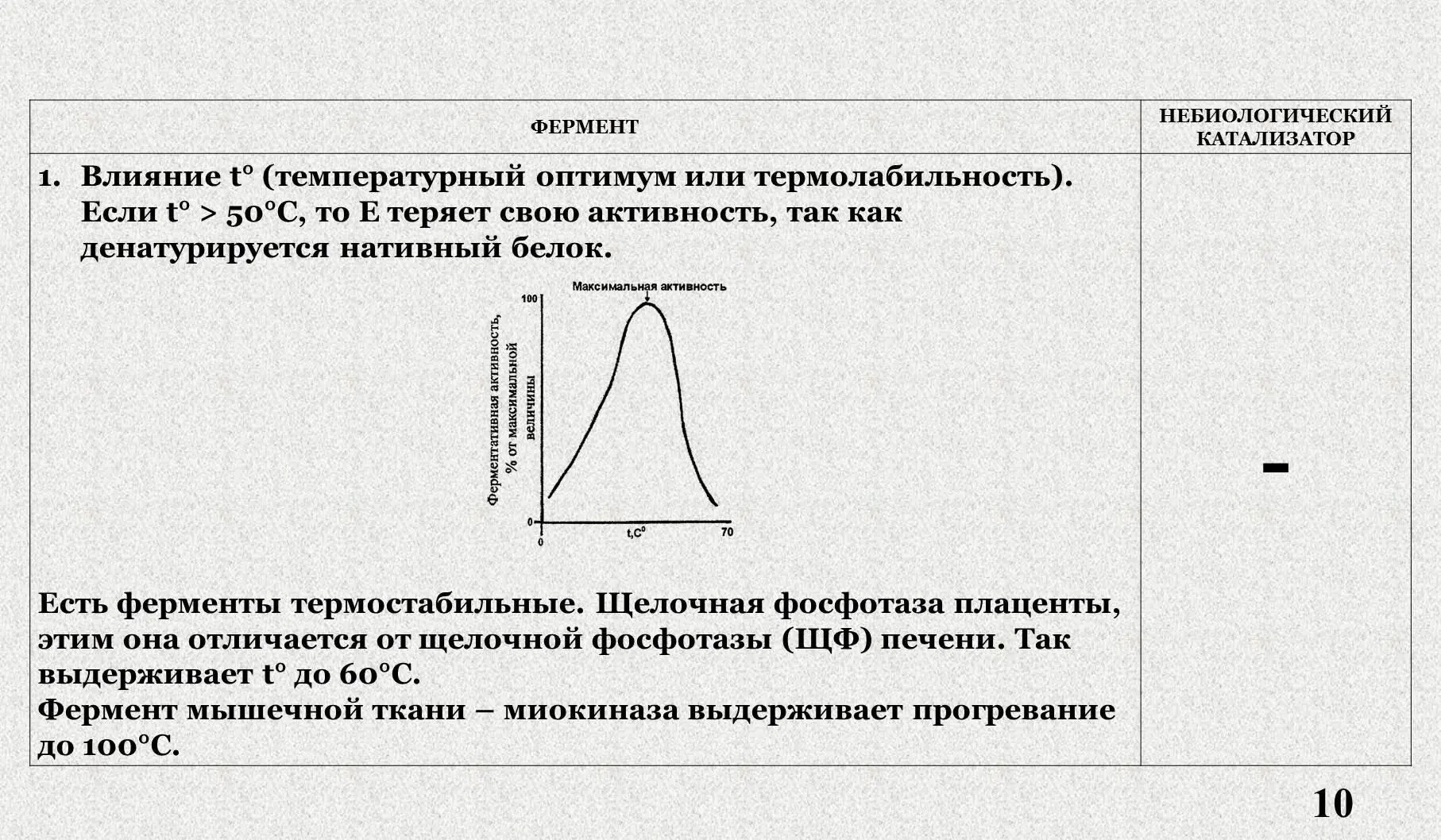
III . Влияние температуры на активность фермента.
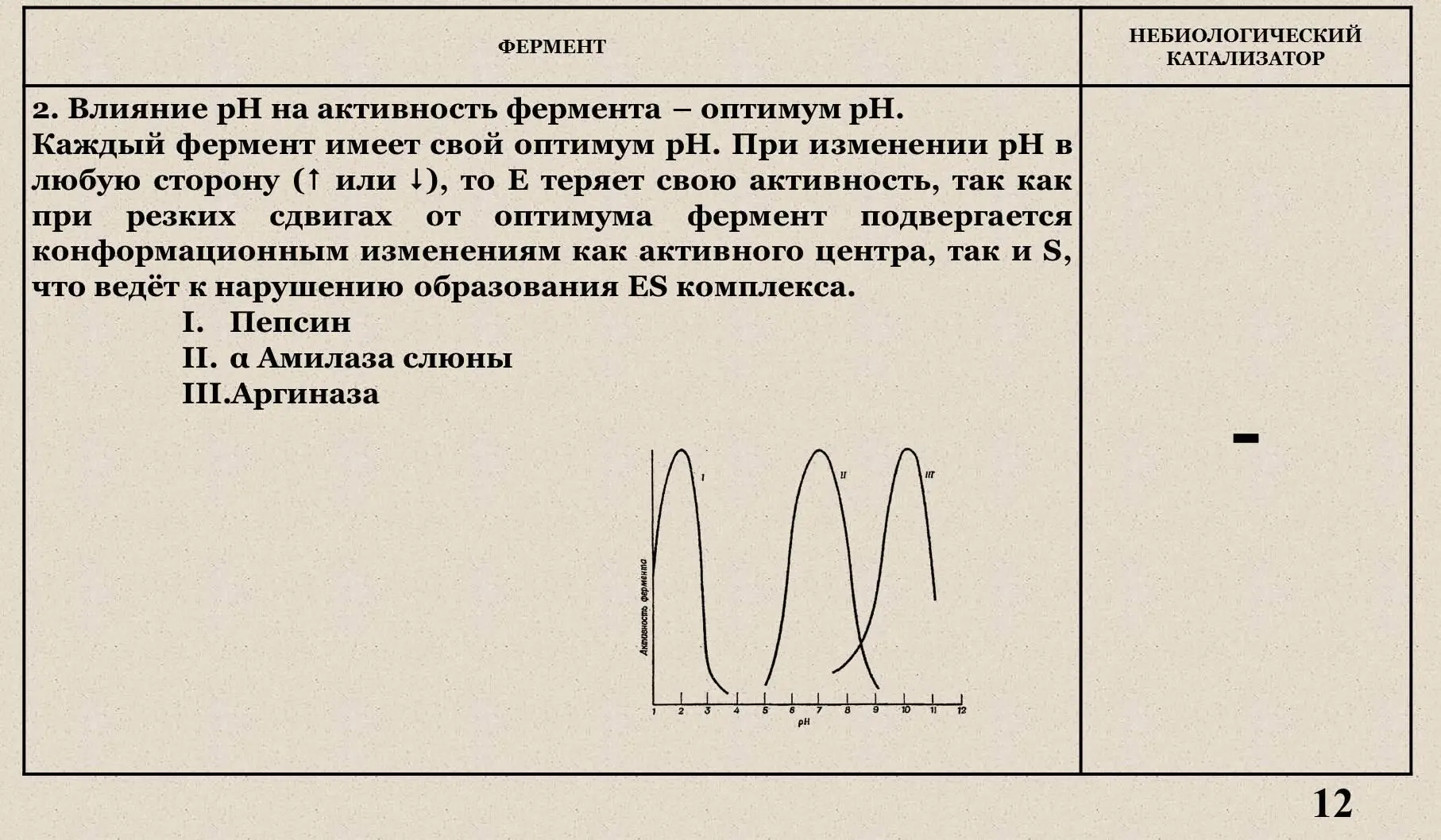
IV . Влияние рН на активность фермента.
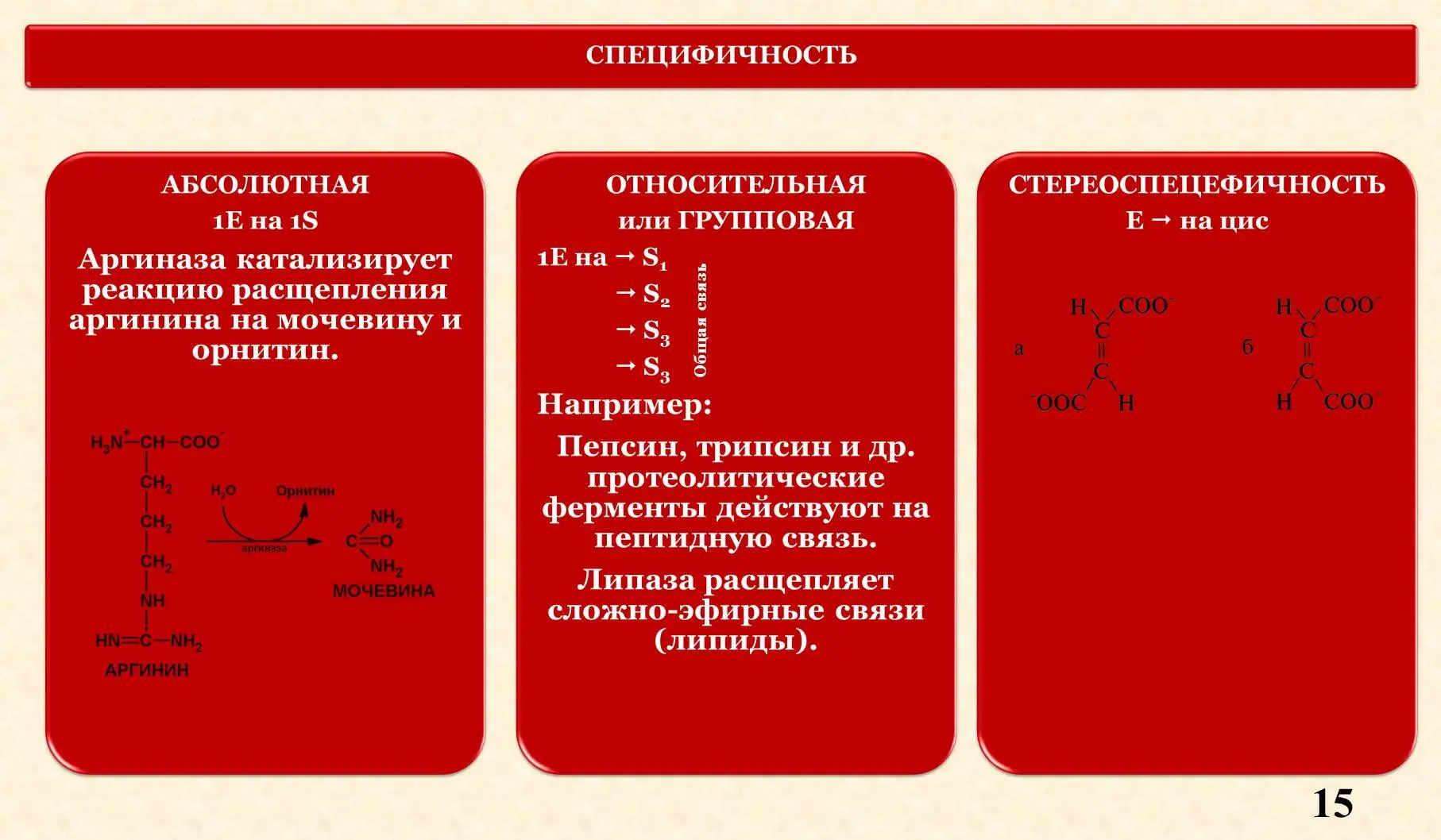
V. Специфичность.


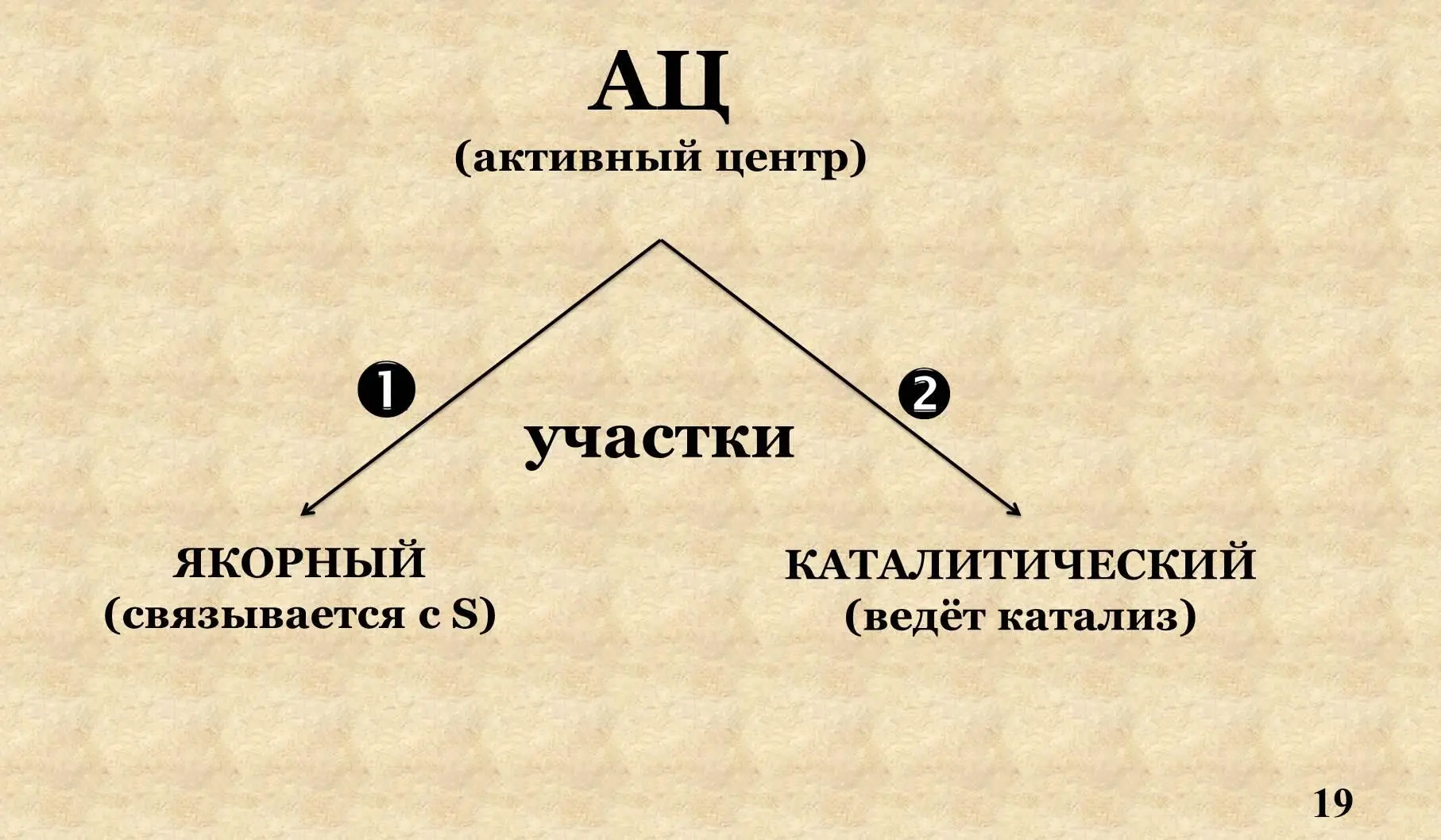
VI . Активный центр.
Активный центр – уникальная комбинация аминокислотных остатков, участвующих в присоединении S и ведении катализа, формируется на уровне третичной структуры.
В первичной структуре участки АЦ расположены далеко друг от друга, например в молекуле протеолитического фермента химотрипсина. Аминокислотные остатки расположены ГИС – 57 положение, АСП – 102 и СЕР – 195.
Согласно теории «индуцированного соответствия» Кошленда, присоединение S к Е вызывает соответствующие изменения конформации А.Ц., что ведёт к образованию ES комплекса.
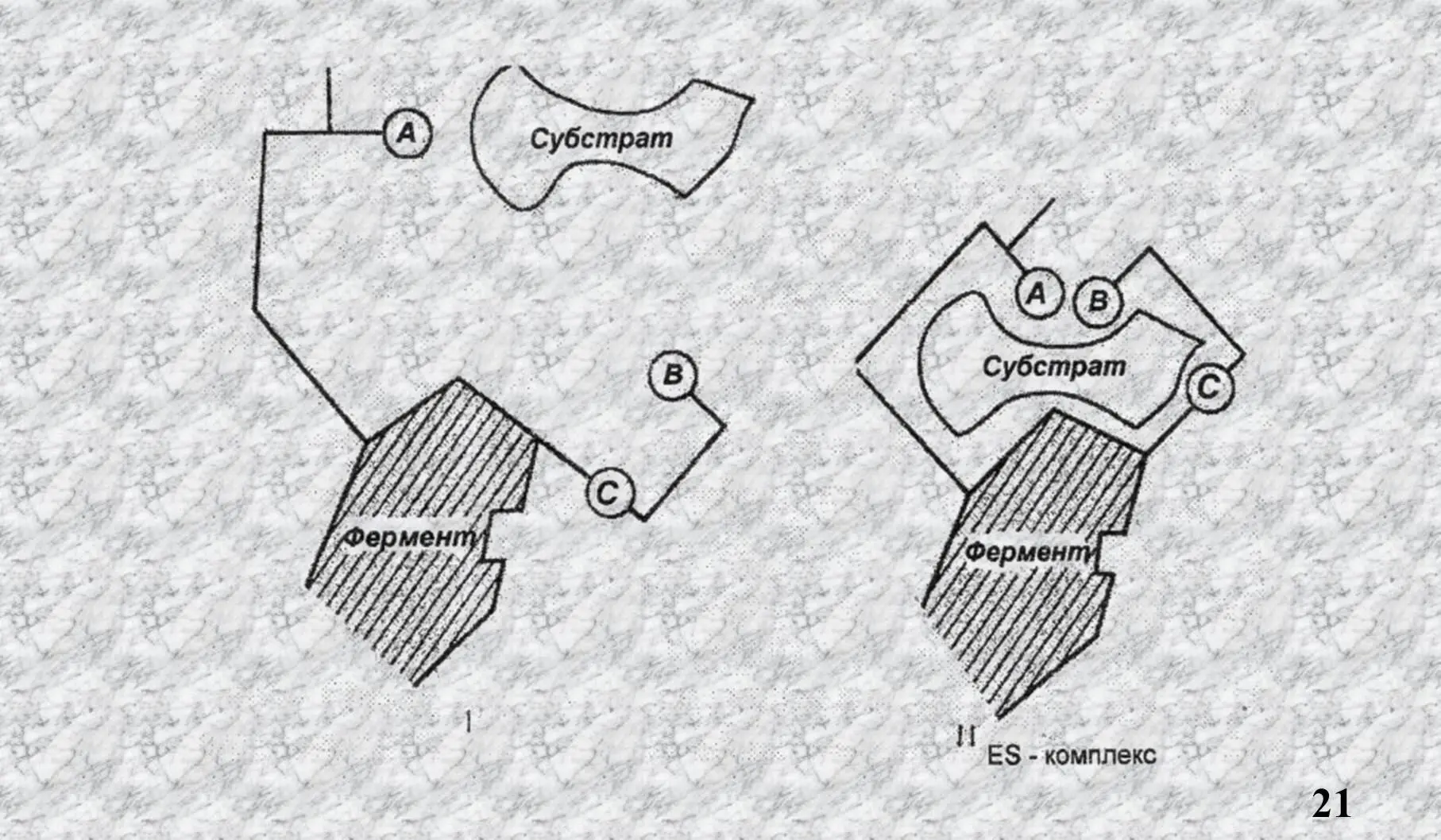
Как видно из рисунка участники А.Ц. при приближении S пространственно сближаются и фермент начинает катализ.
VII . Аллостерический центр.
Аллостерический центр – участок фермента, расположенный вне активного центра, к которому присоединяются низкомолекулярные соединения, а также гормоны. Таким образом он выполняет регуляторную функцию.
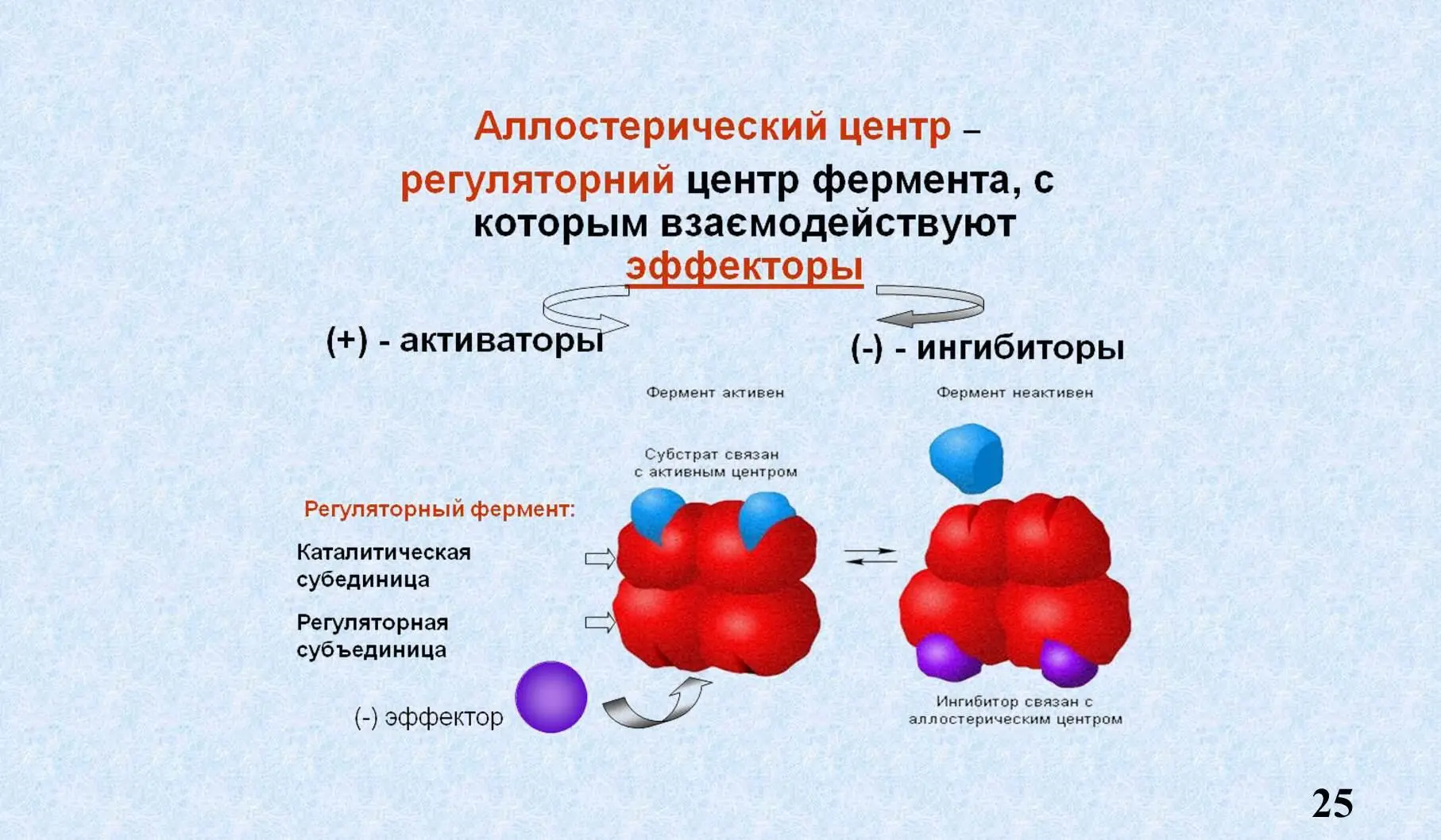
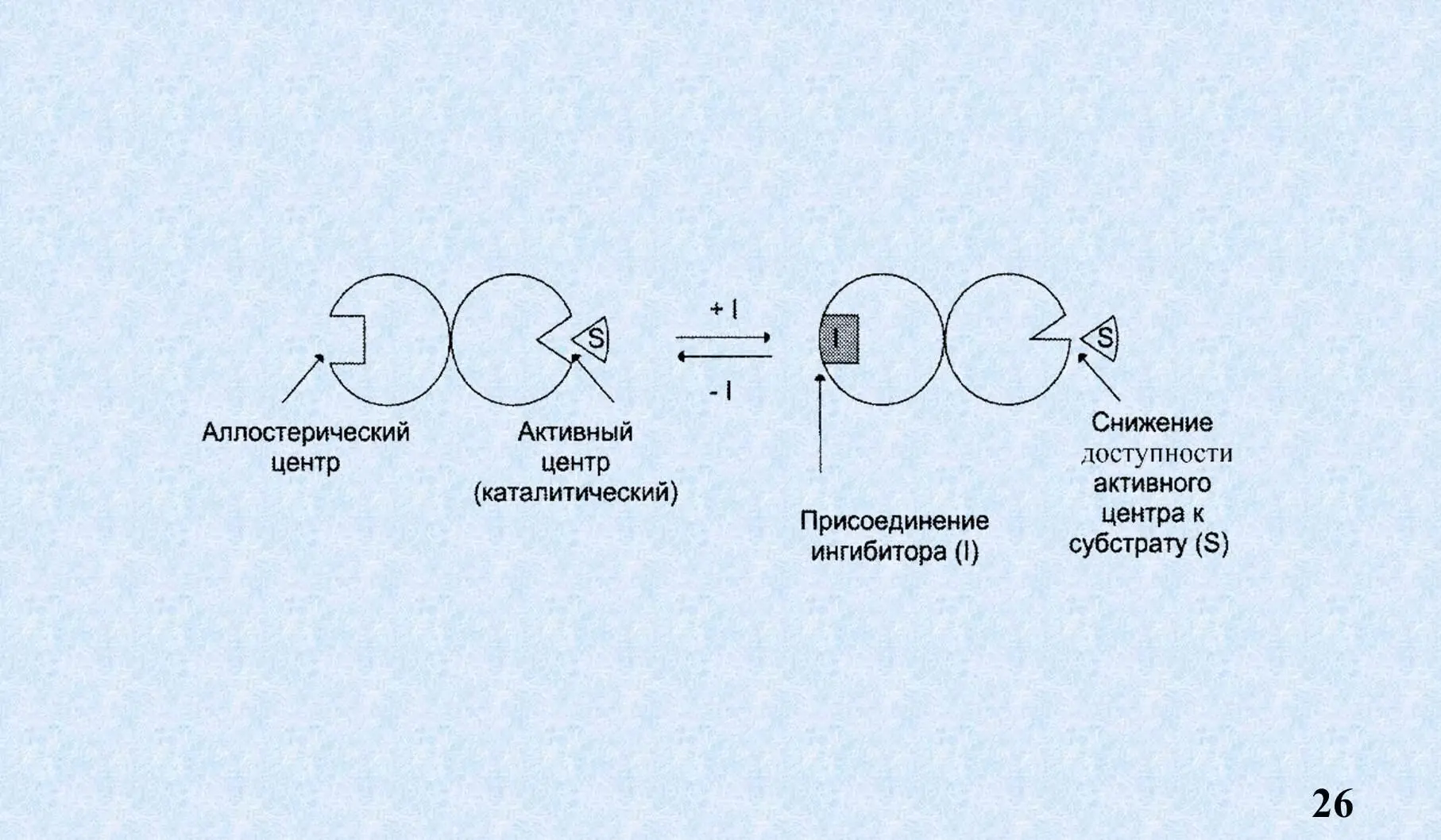
Как мы видим продукт реакции по типу обратной связи взаимодействует с аллостерическим центром, меняет пространственную конфигурацию фермента и образование ES становится невозможным. Это называется аллостерическое ингибирование или ретро ингибирование, или ингибирование продуктом реакции по типу обратной связи.
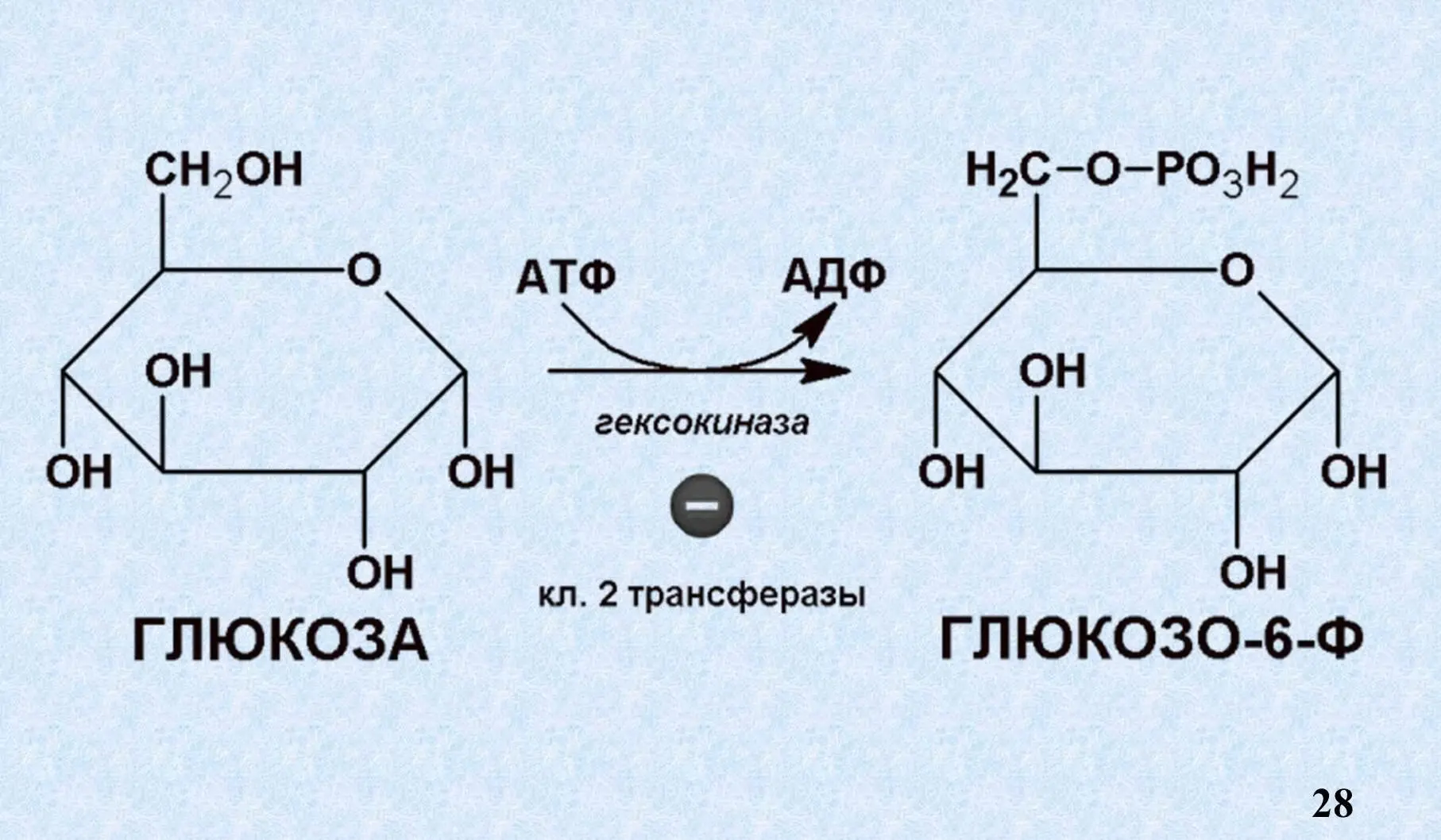
VIII. Особенности ферментативного катализа.
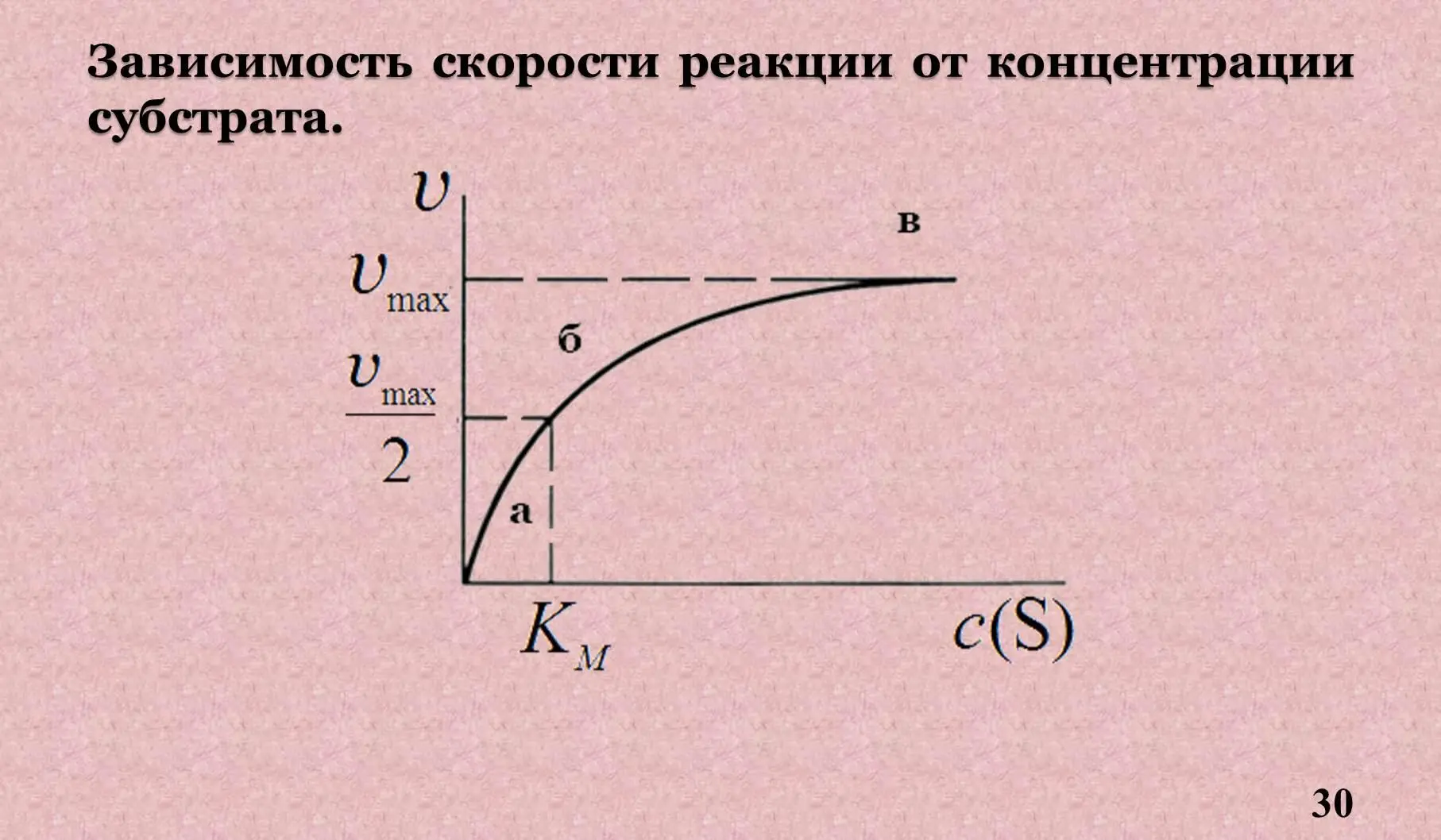
а – реакция первого порядка, скорость реакции пропорциональна концентрации S, именно в зоне а можно определить активность фермента.
б – реакция смешанного порядка.
в – реакция нулевого порядка когда V = V max, и не зависит от концентрации S.
8.1 Константа Михаэлиса.
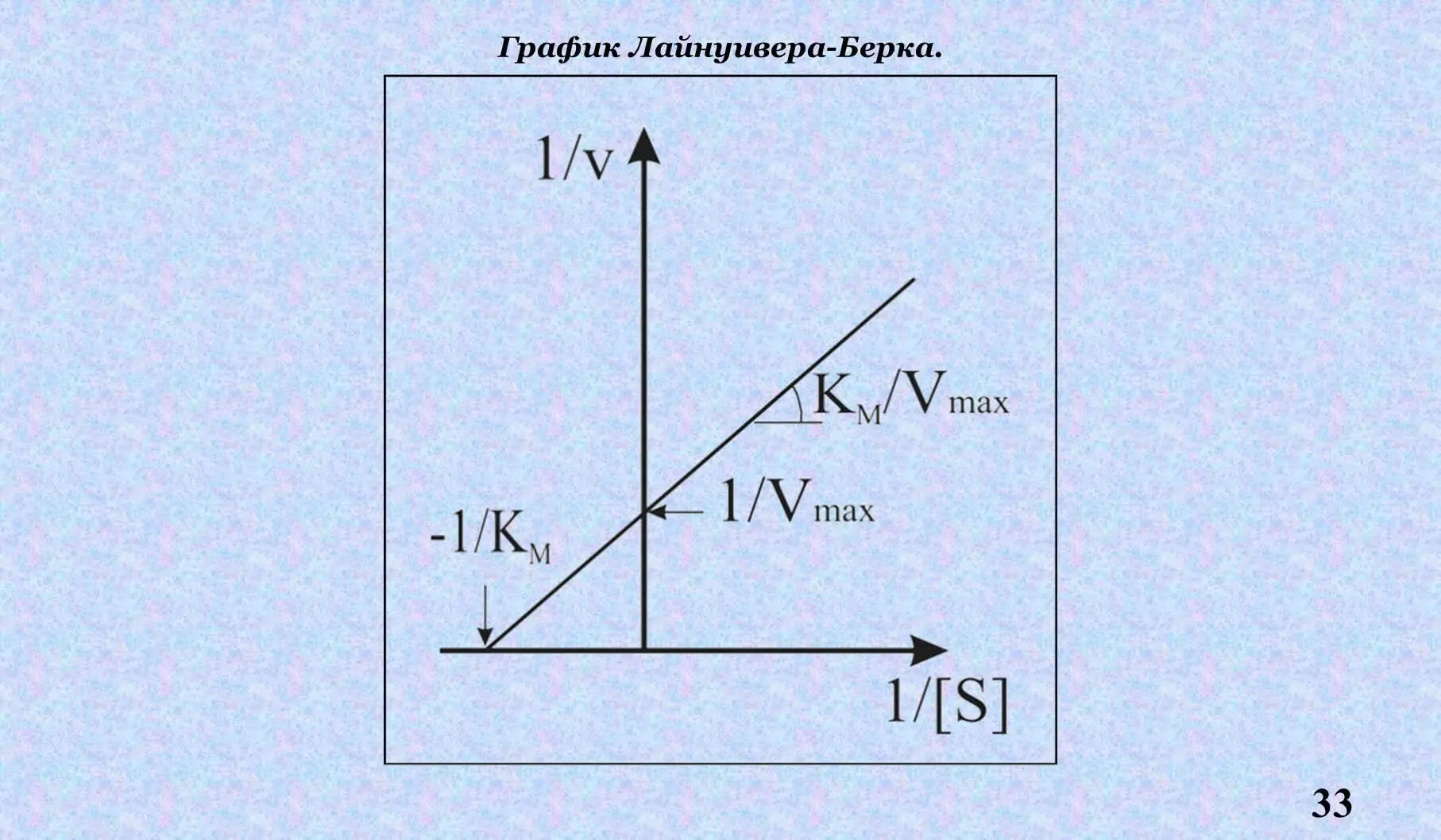
Км – константа Михаэлиса – это концентрация S, при которой скорость соответствует Данная величина изображается также по методу двойных обратных величин – график Лайнуивера-Берка.
Энергия активации – это та энергия, которая необходима, чтобы все молекулы 1 моля вещества пришли в активное состояние. Фермент увеличивает количество активных молекул и снижает уровень энергии активации.
Конец ознакомительного фрагмента.
Читать дальше




























