В 1913 г. Н. Бор предложил модель атома, за основу которой была принята планетарная модель Э. Резерфорда. Согласно ей, атом состоит из положительно заряженного, расположенного в центре, ядра , вокруг которого движутся по своим строго определенным орбитам отрицательно заряженные частицы – электроны , точно так же, как планеты вокруг Солнца (рис. 1).
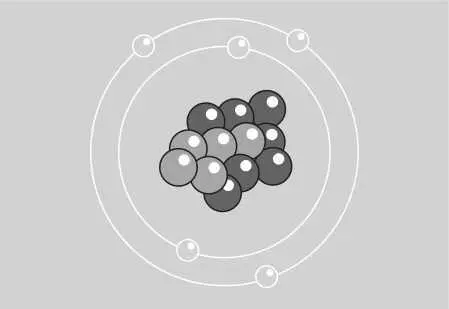
Рис. 1. Схема планетарного строения атома
Эти «летающие планеты» образуют вокруг ядра электронную оболочку. Электроны находятся на различных расстояниях от него. Их количество в атоме таково, что общий заряд нейтрализует положительный заряд ядра. Потеря электрона приводит к ионизации атома.
Кроме электронов, атомы содержат протоны и нейтроны в ядре атома. Протоны имеют положительный заряд. В связи с этим у нейтрального атома равное количество электронов и протонов. Количество протонов в ядре равно порядковому номеру элемента в Периодической системе элементов Д.И. Менделеева.
В отличие от протонов нейтроны не обладают электрическим зарядом. В современной физике протоны и нейтроны объединяют общим названием нуклон (от лат. nucleus – ядро). Общее число нуклонов в атомном ядре соответствует массе атома. Обычно массу атомов всех химических элементов выражают в относительных единицах, условно приняв за единицу 1/12 часть массы основного изотопа углерода С 12.
Диаметр атома приблизительно равен 10 -10м, а его ядро имеет очень малые размеры – 10 -15– 10 - 14м. Принадлежность атома данному элементу обусловлена количеством протонов в ядре. На рис. 2 представлены схематичные модели некоторых атомов.
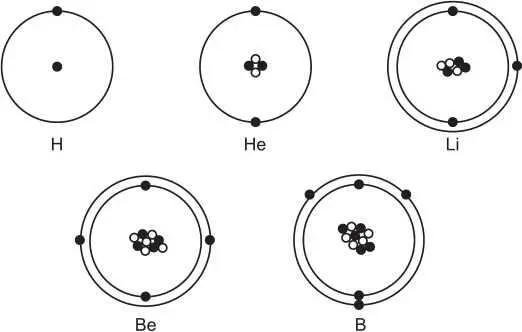
Рис. 2. Схематичные модели атомов водорода, гелия, лития, бериллия, бора
В центре расположено ядро, состоящее из протонов (черные кружки) и нейтронов (белые кружки). Вокруг ядер вращаются электроны. Число протонов в ядрах определяет, какой это элемент.
Изотопы – это разновидности одного и того же химического элемента. Их название (от греч. isos — одинаковый и topos – место) в дословном переводе означает «из одного места», иными словами – вещества, занимающие одно место в Периодической системе элементов Д.И. Менделеева.
Атомы как материальные частицы обладают микроскопической массой. Поэтому физики выражают массу атомов не в единицах массы, а в числах протонов и нейтронов, составляющих ядро данного атома, и называют массовым числом.
Атомы, имеющие ядра с одинаковым числом протонов, но различающихся по числу нейтронов, являются разновидностями одно и того же химического элемента и называются его изотопами. На рис. 3 представлены изотопы водорода.
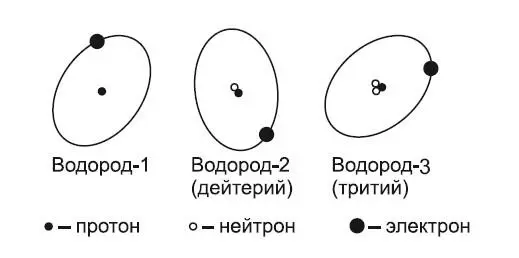
Рис. 3. Изотопы водорода
В ядре его атома либо вообще нет нейтронов, либо есть один или два. Это значит, что водород существует в виде трех изотопов, т. е. в виде трех атомов различной массы, но с одинаковым зарядом ядра. Следовательно, для того чтобы различать изотопы, их обозначают числом, равным сумме входящих в ядро протонов и нейтронов. Для водорода это соответственно водород-1 (обычный), водород-2 (дейтерий), водород-3 (тритий). В ядре цезия-137 содержится 55 протонов и 82 нейтрона (Cs 1 5 3 5 7), в радии-226 содержится 88 протонов и 138 нейтронов (Ra 2 8 2 8 6). Оказалось, что 106 элементов имеют 1600 разновидностей. Из этого числа около 365 изотопов существуют в природе, а свыше 1250 получены искусственно.
Ядра изотопов химических элементов называют нуклидами. Радионуклиды – это радиоактивные атомы с данным массовым числом и атомным номером. Большинство нуклидов нестабильно, они превращаются в другие нуклиды.
Радиоактивность – это самопроизвольное превращение (распад) атомных ядер некоторых химических элементов, приводящее к изменению их атомного номера и массового числа. Распад радиоактивных ядер сопровождается ионизирующим излучением и высокой энергией.
Ионизирующие излучения получили свое название благодаря способности вызывать ионизацию атомов и молекул в облучаемом веществе. Ионизирующие излучения подразделяются по своей природе на электромагнитные и корпускулярные.
Читать дальше
Конец ознакомительного отрывка
Купить книгу















